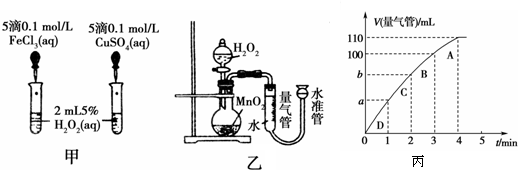
-
对可逆反应4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g),下列叙述正确的是( )
A.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
B.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
C.化学反应速率关系是2v正(NH3)=3v正(H2O)
D.达到化学平衡时,4v正(O2)=5v逆(NO)难度: 中等查看答案及解析
-
下列是4位同学在学习“化学反应的速率和化学平衡“一章后,联系工业生产实际所发表的观点,你认为不正确的是( )
A.化学反应速率理论是研究怎样在一定时间内快出产品
B.化学平衡理论是研究怎样使用有限原料多出产品
C.化学反应速率理论是研究怎样提高原料转化率
D.化学平衡理论是研究怎样使原料尽可能多地转化为产品难度: 中等查看答案及解析
-
可逆反应A(g)+B⇌C(g)+D达到平衡时,下列说法不正确的是( )
A.若增大A的浓度,平衡体系颜色加深,D不一定是具有颜色的气体
B.增大压强,平衡不移动,说明B、D必是气体
C.升高温度,C的百分含量减小,说明正反应是放热反应
D.若B是气体,增大A的浓度会使B的转化率增大难度: 中等查看答案及解析
-
下列变化为放热的化学反应的是( )
A.H2O(g)═H2O(l)△H=-44.0 kJ/mol
B.2HI(g)═H2(g)+I2(g)△H=+14.9 kJ/mol
C.形成化学键时共放出862 kJ能量的化学反应
D.
能量变化如图所示的化学反应难度: 中等查看答案及解析
-
下列关于反应热的说法正确的是( )
A.当△H为“-”时,表示该反应为吸热反应
B.已知C(s)+O2(g)=CO(g)的反应热为110.5kJ/mol,说明碳的燃烧热为110.5kJ
C.反应热的大小与反应物所具有的能量和生成物所具有的能量无关
D.化学反应的反应热只与反应体系的始态和终点状态有关,而与反应的途径无关难度: 中等查看答案及解析
-
实验室进行中和热测定的实验时除需要大烧杯(500mL)、小烧杯(100mL)、温度计、环形玻璃搅拌棒、泡沫塑料盒塑料板外,还需用的其他仪器和试剂均正确的一组是( )
A.0.50 mol•L-1盐酸,0.50 mol•L-1NaOH溶液,100 mL量筒1个
B.0.50 mol•L-1盐酸,0.55 mol•L-1NaOH溶液,100 mL量筒2个
C.0.50 mol•L-1盐酸,0.55 mol•L-1NaOH溶液,50 mL量筒1个
D.0.50 mol•L-1盐酸,0.55 mol•L-1NaOH溶液,50 mL量筒2个难度: 中等查看答案及解析
-
当1g氨气完全分解为氮气、氢气时,吸收2.72kJ的热量,则下列热化学方程式正确的是( )
①N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ/mol
②N2(g)+3H2(g)═2NH3(g)△H=-46.2kJ/mol
③NH3(g)═N2(g)+
H2(g)△H=+46.2kJ/mol
④2NH3(g)═N2(g)+3H2(g)△H=-92.4kJ/mol.
A.①②
B.①③
C.①②③
D.全部难度: 中等查看答案及解析
-
右图表示反应X(g)
4Y(g)+Z(g),△H<0,在某温度时X的浓度随时间变化的曲线:
下列有关该反应的描述正确的是( )
A.第6min后,反应就终止了
B.X的平衡转化率为85%
C.若升高温度,X的平衡转化率将大于85%
D.若降低温度,v正和v逆将以同样倍数减小难度: 中等查看答案及解析
-
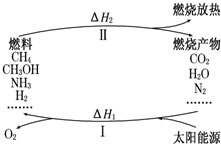
“能源分类相关图”如图所示,四组能源选项中全部符合图中阴影部分的能源是( )

A.煤炭、石油、潮汐能
B.水能、生物能、天然气
C.太阳能、风能、沼气
D.地热能、海洋能、核能难度: 中等查看答案及解析
-
已知1g氢气完全燃烧生成水蒸气时放出热量121kJ,且氧气中1mol O=O键完全断裂时吸收热量496kJ,水蒸气中1mol H-O键形成时放出热量463kJ,则氢气中1mol H-H键断裂时吸收热量为( )
A.920kJ
B.557kJ
C.436kJ
D.188kJ难度: 中等查看答案及解析
-
已知:2Zn(s)+O2(g)=2ZnO(s)△H=-701.0kJ•mol-1 2Hg(l)+O2(g)=2HgO(s)△H=-181.6kJ•mol-1则反应Zn(s)+HgO(s)=ZnO(s)+Hg(l)的△H为( )
A.+519.4kJ•mol-1
B.-519.4kJ•mol-1
C.+259.7kJ•mol-1
D.-259.7kJ•mol-1难度: 中等查看答案及解析
-
如图曲线a表示放热反应 X(g)+Y(g)⇌Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系.若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
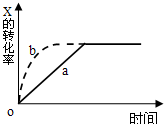
A.缩小体积
B.加大Y的投入量
C.加大N的投入量
D.升高温度难度: 中等查看答案及解析
-
下列叙述中,不正确的是( )
A.某特定反应的平衡常数仅是温度的函数
B.催化剂不能改变平衡常数的大小
C.平衡常数发生变化,化学平衡必定发生移动,达到新的平衡
D.化学平衡发生移动,平衡常数必发生变化难度: 中等查看答案及解析
-
人体血液内的血红蛋白(Hb)易与O2结合生成HbO2,因此具有输氧能力,CO吸入肺中发生反应:CO+HbO2⇌O2+HbCO,37℃时,该反应的平衡常数K=220.HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损.据此,下列结论错误的是( )
A.CO与HbO2反应的平衡常数
B.人体吸入的CO越多,与血红蛋白结合的O2越少
C.当吸入的CO与O2浓度之比大于或等于0.02时,人的智力才会受损
D.把CO中毒的病人放入高压氧仓中解毒,其原理是使上述平衡向左移动难度: 中等查看答案及解析
-
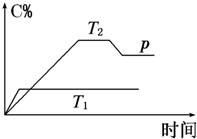
一定条件下,在某密闭容器中进行如下反应:mA(g)+nB(g)⇌pC(g)+qD(g),若增大压强或升高温度,重新达到平衡,反应速率随时间的变化过程如图所示,则对该反应的叙述正确的是( )
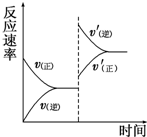
A.正反应是吸热反应
B.逆反应是放热反应
C.m+n<p+q
D.m+n>p+q难度: 中等查看答案及解析
-
把0.6molX气体和0.4molY气体混合于2L容器中,使它们发生如下反应:3X(气)+Y(气)=nZ(气)+2W(气).5min末已生成0.2molW,若测知以Z浓度变化来表示的化学反应平均速率为0.01mol•L-1•min-1,则上述反应中Z气体的计量系数 n的值是( )
A.1
B.2
C.3
D.4难度: 中等查看答案及解析
-
在密闭容器中,给一氧化碳和水蒸气的气体混合物加热,在催化剂存在下发生反应:CO(g)+H2O(g)⇌H2(g)+CO2(g).在500℃时,平衡常数K=9.若反应开始时,一氧化碳和水蒸气的浓度都是0.02mol/L,则在此条件下CO的转化率为( )
A.25%
B.50%
C.75%
D.80%难度: 中等查看答案及解析