-
(14分)已知X、Y、Z、M、G、Q是六种短周期元素,原子序数依次增大。X、Z、Q的单质在常温下呈气态;Y的原子最外层电子数是其电子层数的2倍;X与M同主族;Z、G分别是地壳中含量最高的非金属元素和金属元素。
请回答下列问题:
(1)Y、Z、M、G四种元素原子半径由大到小的顺序是(写元素符号) 。
(2)Z在元素周期表中的位置为 。
(3)上述元素的最高价氧化物对应的水化物酸性最强的是(写化学式) 。
(4)X与Y能形成多种化合物,其中既含极性键又含非极性键,且相对分子质量最小的物质是(写分子式) ,在实验室中,制取该物质的反应原理是(写化学方程式) 。
(5)M2Z的电子式为 。MX与水反应可放出气体,该反应的化学方程式为 。
(6)常温下,不能与G的单质发生反应的是(填序号) 。
a.CuSO4溶液 b.Fe2O3 c.浓硫酸 d.NaOH溶液 e.Na2CO3固体
工业上用电解法制G的单质的化学方程式是 ,若以石墨为电极,阳极产生的混合气体的成分是(写化学式) 。
难度: 中等查看答案及解析
-
(18分)化合物I(C11H12O3)是制备液晶材料的中间体之一,其分子中含有醛基和酯基。I可以用E和H在一定条件下合成:

已知以下信息:① A的核磁共振氢谱表明其只有一种化学环境的氢;
②R—CH=CH2
R—CH2CH2OH;③化合物F苯环上的一氯代物只有两种;④通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基。
请回答下列问题:
(1)A的结构简式为 ,B所含官能团的名称是 。
(2)C的名称为 ,E的分子式为 。
(3)A→B、C→D、F→G的反应类型分别为 、 、 。
(4)写出下列反应的化学方程式;
D→E第①步反应 ;
F→G 。
(5)I的结构筒式为 。
(6)I的同系物J比I相对分子质量小14,J的同分异构体中能同时满足如下条件:①苯环上只有两个取代基,②既能发生银镜反应,又能与饱和NaHCO3溶液反应放出CO2,共有 种(不考虑立体异构)。J的一种同分异构体发生银镜反应并酸化后核磁共振氢谱为三组峰,且峰面积比为2:2:1,写出J的这种同分异构体的结构简式 。
难度: 极难查看答案及解析
-
(14分)科学家一直致力于研究常温、常压下“人工固氮”的新方法。曾有实验报道:在常温、常压、光照条件下,N2在催化剂(混有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3。进一步研究NH3生成量与温度的关系,部分实验数据见下表(光照、N2压强1.0×105 Pa、反应时间3 h):
T/K
303
313
323
353
NH3生成量/(10-6mol)
4.8
5.9
6.0
2.0
相应的热化学方程式如下:N2(g)+3H2O(1)==2NH3(g)+ O2(g) △H=+765.2 kJ/mol (I)
请回答下列问题:
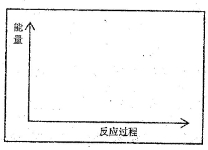
(1)请在方框内的坐标系中,画出反应(I)在有催化剂与无催化剂两种情况下反应过程中体系能量变化示意图,并进行必要标注。
(2)与目前广泛使用的工业合成氨方法相比,该方法中固氮反应速率慢。请提出可提高其反应速率且增大NH3日生成量的建议: 。
(3)写出工业上用H2和N2直接合成NH3的化学方程式 ,设在2.0 L的密闭容器中充入0.60mol N2(g)和1.60mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总物质的量之比)为4/7。计算该条件下N2的平衡转化率为 ;反应的平衡常数K= (不要求写单位)。
难度: 困难查看答案及解析