-
下列各组中两种微粒所含电子数不相等的是
A. S2-和Al3+ B. CO和N2 C. H3O+和OH- D. NH3和NH4+
难度: 简单查看答案及解析
-
一种铂(Pt)原子的质量数是196,质子数比中子数少40。该原子的核素符号是
A.
B.
C.
D.
难度: 简单查看答案及解析
-
下列说法错误的是
A. 氢是原子半径最小的元素 B. 氟是非金属性最强的元素
C. 硅元素适合作半导体材料 D. 稀有气体元素原子的最外层电子数均为8
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数值。下列有关叙述正确的是
A. 1 mol D2O分子所含的中子数为8NA
B. 48 g氧气和臭氧的混合气体中的氧原子数为3NA
C. 11.2 L 甲烷(CH4)中的共价键数为2NA
D. 1 mol N2与3 mol H2反应生成的NH3分子数为2NA
难度: 中等查看答案及解析
-
下列关于铍元素及其化合物的性质的推测正确的是( )
A. 铍原子的半径大于硼原子的半径
B. 相同条件下,单质铍与酸反应比与单质锂酸反应剧烈
C. 氢氧化铍的碱性比氢氧化钙的碱性强
D. 单质铍能与冷水剧烈反应
难度: 中等查看答案及解析
-
下列物质中,有非极性共价键的是
A. 氨 B. 二氧化碳 C. 过氧化钠 D. 次氯酸
难度: 中等查看答案及解析
-
下列有关化学用语表示正确的是
A. Mg原子的结构示意图
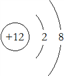
B. OCl2分子的电子式
C. HF分子的电子式
D. Na2S形成的电子式
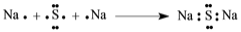
难度: 简单查看答案及解析
-
下列说法错误的是
A. 燃料的燃烧反应都是放热反应
B. 一定量的燃料完全燃烧放出的热量比不完全燃烧放出的热量大
C. 放热反应的逆反应一定是吸热反应
D. 加热能发生的反应是吸热反应
难度: 简单查看答案及解析
-
一定条件下,某容器中各微粒在反应前后变化的示意图如下:(其中●代表氧原子,○代表硫原子)
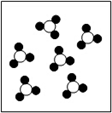
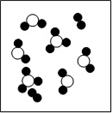
反应前 反应后
关于此反应说法错误的是
A. 一定属于分解反应 B. 一定属于氧化还原反应
C. 一定属于放热反应 D. 一定属于可逆反应
难度: 中等查看答案及解析
-
如果用铁片和铜片构成柠檬电池,会发生的是
柠檬电池
A. 铜片上发生反应:Cu - 2e- ═ Cu2+ B. 铁片是负极,其质量逐渐减小
C. 电流由铁片经导线流向铜片 D. 柠檬中蕴含的电能转化为化学能
难度: 简单查看答案及解析
-
氢气在氯气中燃烧时产生苍白色火焰。在反应过程中,断裂1mol H2中的化学键消耗的能量为Q1 kJ,断裂1mol Cl2中的化学键消耗的能量为Q2 kJ,形成1mol HCl中的化学键释放出的能量为Q3 kJ。下列关系式中正确的是
A. Q1 + Q2﹤Q3 B. Q1 + Q2﹤2Q3
C. Q1 + Q2﹥Q3 D. Q1 + Q2﹥2Q3
难度: 简单查看答案及解析
-
元素周期律表明
A. 随着原子序数的增大,元素的主要化合价逐渐增加
B. 随着相对原子质量的增大,元素的化学性质会不断重复
C. 与碱金属相比,其相邻主族的(碱土)金属具有更小的密度和硬度
D. 卤素氢化物的稳定性随着核电荷数的增加而减弱
难度: 中等查看答案及解析
-
X、Y、Z、W是原子序数依次增大的短周期元素,它们的最外层电子数分别为1、1、6、7。X-的电子层结构与氦相同,Y、Z和W的次外层有8个电子。下列叙述错误的是
A. 元素X、Z、W各自最高和最低化合价的代数和分别为1、4、6
B. 原子半径的大小为Y﹥Z﹥W
C. 元素的非金属性顺序为W﹥Z﹥X
D. Y和其他3种元素均能形成离子化合物
难度: 中等查看答案及解析
-
金刚石和石墨是碳元素的两种结构不同的单质(同素异形体)。在100 kPa时,1mol石墨转化为金刚石,要吸收1.895 kJ的热能。试判断在100 kPa时,下列结论正确的是
A. 金刚石比石墨稳定
B. 1mol石墨比1mol金刚石的总能量高
C. 若在等量氧气中充分燃烧,1mol金刚石比1mol石墨的释放的能量高
D. 仅提供1.895 kJ的热能,工业上就能将1mol石墨转化为金刚石
难度: 中等查看答案及解析