-
下列变化中,属于化学变化的是( )
A.滴水成冰
B.苹果汁露置在空气中变色
C.刻舟求剑
D.洗洁精乳化油污难度: 中等查看答案及解析
-
下列常见的生活用品中,主要使用合成纤维材料制成的是 ( )
A.
橡胶鞋底
B.
尼龙背包
C.
纯棉T恤
D.
塑料纸篓难度: 中等查看答案及解析
-
化学氮肥可导致硝酸盐在蔬菜体内大量富集,进入人体后会还原为亚硝酸,对人体健康构成潜在威胁.已知亚硝酸中氮元素为+3价,则其化学式为( )
A.HNO
B.HNO2
C.HNO3
D.H2NO4难度: 中等查看答案及解析
-
下列预设应用方案中,能够达到预期目的是( )
A.研制新型的催化剂,可使水变成油
B.用碳酸氢钠溶液可中和过多的胃酸
C.在自来水中加入净水剂(明矾),可使硬水变成软水
D.在实验室做测定空气中氧气含量的实验时,用蜡烛代替红磷难度: 中等查看答案及解析
-
据报道:“10吨氦-3经过核聚变产生的能量,足够维持全世界1年的消耗,月球上有丰富的氦-3资源.”已知氦原子的质子数为2,则下列关于氦-3原子的说法正确的是( )
A.氦-3原子的最外层有1个电子
B.氦-3原子中有3个中子
C.氦-3原子的核电荷数是3
D.氦-3原子的相对原子质量为3难度: 中等查看答案及解析
-
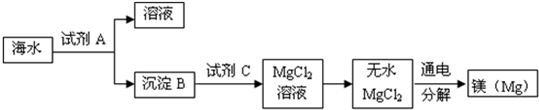
有一包久置生石灰干燥剂,其成分可能为CaO、Ca(OH)2、CaCO3中的一种或几种,测得其中Ca元素质量分数为60%,取该混合物10g,加足量稀盐酸完全溶解,生成CaCl2的质量约为( )
A.11.1g
B.15.0g
C.16.7g
D.19.8g难度: 中等查看答案及解析
-
在化合、分解、置换、复分解四个基本反应类型中可能生成水的反应有( )
A.4类
B.3类
C.2类
D.1类难度: 中等查看答案及解析
-
近日热点:食品中添加塑化剂会使人致癌,塑化剂的化学式为C24H38O4,则下列有关塑化剂的说法中错误的是( )
A.塑化剂分子中含有63个原子
B.塑化剂的元素组成与葡萄糖相同
C.塑化剂是有机物
D.塑化剂中质量分数最小的是氢元素难度: 中等查看答案及解析
-
下列有关实验现象的描述,错误的是( )
A.SO2气体通入高锰酸钾溶液后,溶液颜色会褪去
B.氨气遇氯化氢气体产生白色烟雾
C.将Cu(OH)2和葡萄糖在碱性溶液中加热至沸腾出现红色色沉淀
D.蛋白质遇浓硝酸变黄色难度: 中等查看答案及解析
-
在 pH为12的无色水溶液中可能大量存在的离子组是( )
A.MnO4-、Cl-、Na+、K+
B.K+、CO32-、Ca2+、NO3-
C.Cl-、K+、SO42-、Na+
D.K+、Cl-、Mg2+、Na+难度: 中等查看答案及解析
-
欲除去不纯物质中的杂质(括号内为杂质),所用试剂和方法均正确的是( )
选项 待提纯物质 除去杂质的试剂及方法 A NH3(H2O) 通过足量的浓硫酸 B CuO(Cu) 加入足量的稀盐酸后,洗涤、干燥 C CaCO3(Ca(OH)2) 加入足量水中,通入过量的CO2 D NaCl(Na2CO3) 加适量氯化钙溶液,过滤、蒸发,结晶
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
下列常见物质中,pH大于7的( )
①柠檬汁;②食盐水;③雨水;④白醋;⑤海水;⑥肥皂水;⑦纯碱溶液;⑧明矾溶液.
A.②③⑤⑧
B.⑥⑦⑧
C.①③④⑧
D.⑤⑥⑦难度: 中等查看答案及解析
-
植物生长离不开“营养”元素,合理使用化肥能促进农业增产,下列化肥中属于复合肥的是( )
A.Ca3(PO4)2
B.NH4HCO3
C.K2CO3
D.KNO3难度: 中等查看答案及解析
-
2009年10月28日,人类历史上威力最大的美国“战神Ⅰ-X”火箭成功试飞,其二级火箭为液氧及液氢的低温引擎,下列关于此引擎的说法不合理的是( )
A.液氢质量小,节省火箭质量空间
B.液氧作燃料效果好
C.燃烧产物无污染
D.燃烧时放热多,推进力大难度: 中等查看答案及解析
-
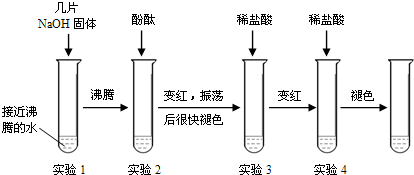
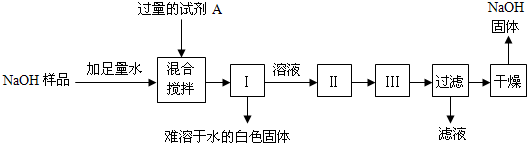
“碱石灰”是CaO和NaOH固体的混合物,是实验室常用的干燥剂.同学们对一瓶久置的“碱石灰”样品的成分,进行如下实验探究:(1)取“碱石灰”样品,加足量水溶解,过滤,得滤渣和滤液.(2)取滤液少许与试管中,加足量CaCl2溶液,有白色沉淀生成,再加无色酚酞试液,变红.下列关于样品成分的分析正确的是( )
A.一定含NaOH
B.一定含Na2CO3
C.一定含NaOH、CaO中的一种或两种
D.一定含有CaCO3难度: 中等查看答案及解析
-
请根据所学化学知识判断,下列做法中正确的是( )
A.用氧气充入食品包装袋以防腐
B.用甲醛浸泡水产品使之长期不变质
C.用氢氧化钠溶液和树叶做“叶脉书签”
D.碱性溶液中不一定有OH-难度: 中等查看答案及解析
-
比较推理是化学学习中常用的思维方法,下列有关物质的比较推理中正确的是( )
A.石蕊试液能使稀盐酸和稀硫酸变红色
B.NaCl 和 NaNO2 都是有咸味的盐,故可以用NaNO2代替NaCl作食用盐
C.氢氧化钠和氢氧化铜都是碱,都能使酚酞试液变红
D.H2O 和 H2O2 分子构成不同,所以化学性质不同难度: 中等查看答案及解析
-
“土豆农膜”是一种新型环保农膜,通过在塑料中添加土豆淀粉制成.“土豆农膜”可被细菌和微生物释放的酶分解.下列有关说法错误的是( )
A.塑料属于天然高分子材料
B.淀粉属于高分子化合物
C.该新型农膜有助于解决农村“白色污染”问题
D.土豆农膜比普通塑料农膜容易降解难度: 中等查看答案及解析
-
用铝屑,稀硫酸,氢氧化钠溶液制备Al(OH)3有如下三种方案:
方案一:2Al+3H2SO4=Al2(SO)3+3H2↑ Al2(SO)3+6NaOH=2Al(OH)3↓+3Na2SO4
方案二:2Al+2NaOH+2H2O=2NaAlO2+3H2↑ 2NaAlO2+H2SO4+2H2O=2Al(OH)3↓+Na2SO4
方案三:2Al+3H2SO4=Al2(SO)4+3H2↑ 2Al+2NaOH+2H2O=2NaAlO2+3H2↑
Al2(SO)3+6NaAlO2+12HO=8Al(OH)3↓+3Na2SO4
欲制取相同质量的Al(OH)3(假设原料的利用率为100%),有关说法正确的是( )
A.三种方案中产生氢气的质量相等
B.三种方案中消耗铝屑的质量不相等
C.方案三中消耗的硫酸质量最小
D.方案二中消耗氢氧化钠的质量最小难度: 中等查看答案及解析
-
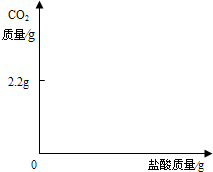
有一铁粉和氧化铜的混合物6.96g,进行如下实验:根据实验所得数据,关于混合物相关说法正确的是( )

A.生成气体质量为0.2g
B.原混合物中铁的质量分数无法计算
C.实验中反应的H2SO4质量为10.78g
D.原混合物中铜元素的质量不一定为0.64g难度: 中等查看答案及解析