-
下列对能量转化的认知中,正确的是
A.电解水生成H2和O2时,化学能主要转化为电能
B.风力发电时,风能主要转化为电能
C.煤燃烧时,热能主要转化为化学能
D.白炽灯工作时,只发生电能转化为光能
难度: 简单查看答案及解析
-
下列说法正确的是
A.需要加热才能发生的反应一定是吸热反应
B.化学反应中的能量变化都表现为热量变化
C.可逆反应达到化学平衡时,正、逆反应速率都为0
D.反应物和生成物所具有的总能量决定了反应是放热还是吸热
难度: 中等查看答案及解析
-
下列图示变化为吸热反应的是

难度: 中等查看答案及解析
-
影响化学反应速率的主要因素是:
A.温度
B.压强
C.浓度
D.反应物本身的性质
难度: 简单查看答案及解析
-
下列说法中有明显错误的是
A.对有气体参加的化学反应,增大压强(体系体积减小),可使单位体积内活化分子数增加,因而反应速率增大
B.升高温度,一般可使活化分子的百分数增大,因而反应速率增大
C.活化分子之间发生的碰撞一定为有效碰撞
D.加入适宜的催化剂,可使活化分子的百分数大大增加,从而成千上万倍地增大化学反应的速率
难度: 中等查看答案及解析
-
对于300mL1mol·L-1盐酸与铁
片的反应,其中能使反应速率加快的措施:
A.升高温度
B.再加300mL1mol·L-1盐酸
C.用等量铁片代替铁粉
D.改用100mL98%的硫酸
难度: 中等查看答案及解析
-
一定温度下,可逆反应3X(g)+Y(g)
2Z(g)达到平衡的标志是:
A.单位时间内生成3nmolX,同时生成nmolY
B.2v逆(Y)=v正(Z)
C.X、Y、Z的浓度相等
D.X、Y、Z的分子个数比为3:1:2
难度: 中等查看答案及解析
-
在不同条件下分别测得反应2A(g)+3B(g)
C(g)+2D(g)的化学反应速率,其中表示该反应进行的最快的是
A.v(A)=3mol•L﹣1•min﹣1
B.v(B)=6mol•L﹣1•min﹣1
C.v(C)=2.5mol•L﹣1•min﹣1
D.v(D)=4mol•L﹣1•min﹣1
难度: 中等查看答案及解析
-
下列叙述中,不能用勒夏特列原理解释的是
A.红棕色的NO2,加压后颜色先变深后变浅
B.高压比常压有利于合成SO3的反应
C.由H2(g)、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深
D.黄绿色的氯水光照后颜色变浅
难度: 中等查看答案及解析
-
在密闭容器中发生反应H2(g)+I2(g)
2HI(g),0~5min内H2的浓度减少了0.1mol/L,则在这段时间内用HI表示的平均反应速率为
A.0.01mol·L-1·min-1
B.0.04mol·L-1·min-1
C.0.2mol·L-1·min-1
D.0.5mol·L-1·min-1
难度: 中等查看答案及解析
-
当反应:N2(g)+3H2(g)
2NH3(g)ΔH1<0达到平衡状态时,下列选项中一定能使该反应朝正反应方向移动的是
A.升高温度
B.加入催化剂
C.增大H2(g)的浓度
D.增大NH3(g)的浓度
难度: 中等查看答案及解析
-
在一恒温恒容密闭容器中充入1molCO2和3molH2,一定条件下发生反应:
CO2(g)+3H2(g)
CH3OH(g)+H2O(g)△H=-49.0kJ/mol
测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。下列说法正确的是
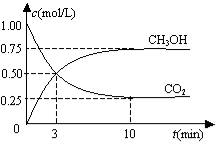
A.反应进行到3min时,该反应达到平衡状态
B.从反应开始到平衡,CO2的转化率为25%
C.第3min时,氢气的平均反应速率为1.5mol/(L·min)
D.该温度下,反应的平衡常数的值为
难度: 困难查看答案及解析
-
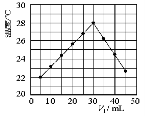
在密闭容器中进行下列反应:M(g)+N(g)
R(g)+2L,此反应符合下面图像,下列叙述正确的是
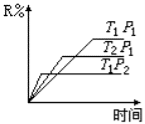
A.正反应放热,L是固体或液体
B.正反应放热,L是气体
C.正反应吸热, L是固体
D.正反应吸热,L是气体
难度: 困难查看答案及解析
-
下列热化学方程式正确的是
A.甲烷的标准燃烧热为890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)===CO2(g)+2H2
O(g)ΔH=-890.3kJ·mol-1
B.已知:H2(g)+1/2O2(g)=H2O(g)⊿H=—Q1kJ/mol,则2H2O(l)=2H2(g)+O2(g)⊿H=—2Q1kJ/mol
C.已知1g液态肼和足量液态过氧化氢反应生成氮气和水蒸气时放出20.05kJ的热量,其热化学方程式为N2H4(l)+2H2O2(l)===N2(g)+4H2O(g)ΔH=-641.6kJ·mol-1
D.已知:强酸和强碱的稀溶液中和热可表示为:H+(aq)+OH-(aq)=H2O(l)ΔH=-57.3kJ/mol,则H2SO4(aq)+Ba(OH)2(aq)=BaSO4(aq)+2H2O(l)ΔH=-114.6kJ/mo
难度: 中等查看答案及解析
-
在密闭容器中发生如下反应:mA(g)+nB(g)
pC(g),达到平衡后,保持温度不变,将气体体积缩小到原来的一半,当达到新平衡时,C的浓度为原来1.9倍,下列说法错误的是
A.m+n>p
B.平衡向逆反应方向移动
C.A的转化率降低
D.C的体积分数减小
难度: 中等查看答案及解析
-
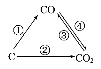
反应A(g)+B(g)→C(g)ΔH,分两步进行:①A(g)+B(g)→X(g)ΔH1,②X(g)→C(g)ΔH2,反应过程中能量变化如图所示,E1表示A(g
)+B(g)
→X(g)的活化能,下列说法正确的是
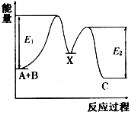
A.ΔH=E1-E2
B.E1是反应①的活化能
C.X是反应A(g)+B(g)→C(g)的催化剂
D.ΔH2>0
难度: 中等查看答案及解析
-
mA(s)+nB(g)
qC(g);ΔH<0的可逆反应,在一定温度下的密闭容器中进行,平衡时B的体积分数V(B)%与压强(P)关系如下图所示,下列叙述正确的是
A、m+n<qB、X点时的状态,V正>V逆
C、n<qD、X点比Y点混和物的正反应速率慢
难度: 困难查看答案及解析
-
向某密闭容器中加入0.3molA、0.1molC和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如甲图所示[t0~t1阶段c(B)未画出]。附图乙为t2时刻后改变条件平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件并且所用条件均不同。已知,t3~t4阶段为使用催化剂。下列说法正确的是
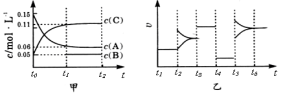
A.该反应一定是放热反应
B.t4~t5阶段改变的条件为减小压强
C.B的起始物质的量为0.02mol
D.该反应的化学方程式为3A(g)+B(g)
2C(g)
难度: 困难查看答案及解析