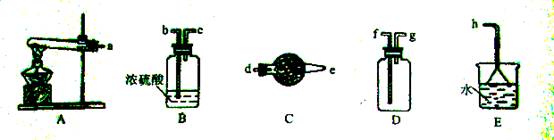
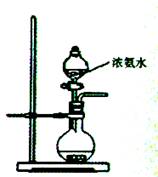
-
化学已经渗透到人类生活的各个方面,下列说法不正确的是( )
A.高铁酸钾(K2Fe04)是一种新型、高效、多功能水处理剂,既能消毒杀菌又能净水。
B.“光化学烟雾”、“臭氧空洞”的形成都与氮氧化合物有关
C.低碳生活注重节能减排,尽量使用太阳能等代替化石燃料,减少温室气体的排放
D.高纯度的硅单质广泛用于制作光导纤维.光导纤维遇强碱会“断路”
难度: 简单查看答案及解析
-
下列事实不能证明HN02是弱电解质的是( )
①滴入酚酞,NaN02溶液显红色
②用HN02溶液做导电实验,灯泡很暗
③等pH、等体积的盐酸和HN02溶液中和碱时,HNO2的中和碱能力强
④0.1 mol·L-1HN02溶液的PH=2
⑤HN02与CaCO3反应放出CO2气体
⑥C(H+)=0.1 mol·L-1的HN02溶液稀释至1000倍,PH<4
A.①⑤ B.②⑤ C.③⑥ D. ③④
难度: 简单查看答案及解析
-
25OC时,下列溶液中有关微粒的物质的量浓度关系错误的是( )
A.pH=2的HA溶液与pH=12的MOH溶液以任意比混合:[H+]+[M+]=[OH-]+[A-]
B.pH=4的NaHA溶液:[HA-]>[H+]>[H2A]>[A2-]
C.将醋酸钠、盐酸两溶液混合后呈中性的溶液中:[Na+]=[CH3COO-]+[CH3COOH]
D.氨水和氯化铵的混合溶液,可能会出现[NH4+]>[OH-]>[Cl-]>[H+]
难度: 简单查看答案及解析
-
用
表示阿佛加德罗常数,下列说法正确的是( )
A.标准状态下22.4LS03分子数为
B.7.8gNa202含有的阴离子数是0.2
C.常温常压下,l6g02和16g03中所含原子数均为
D.1L2mol·L-1的Al(NO3)3溶液中含Al3+个数为2
难度: 中等查看答案及解析
-
下列各组离子在指定溶液中,一定能大量共存的是( )
A.无色溶液中:K+、H+、NO3-、[A1(0H)4]-
B.能与铝片反应产生氢气的溶液中:Al3+、Cl-、Fe2+、NO3-
C.在由水电离出的c(H+)=10-12mol·L-1的溶液中:Na+、Ba2+、Cl-、Br-
D.含有较多Fe3+的溶液中:Na+、S042-、SCN-、I-
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.需要加热才能发生的反应一定是吸热反应
B.任何放热反应在常温条件下一定能发生反应
C.反应物和生成物所具有的总能量决定了该反应是放热还是吸热
D.C(石墨,s)=C(金刚石,s)△H>0,所以金刚石比石墨稳定
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是( )
A.实验室用Fe和稀硫酸制氢气:
B.用浓盐酸与Mn02反应制取少量氯气:MnO2+4H++2Cl-=Mn2++Cl2↑+2H2O
C.向碳酸氢钠溶液中加入氢氧化钠:
D.用氢氧化钠溶液除去铝表面的氧化膜:
难度: 中等查看答案及解析
-
.下列对化学知识概括合理的是( )
A.酸性氧化物都是非金属氧化物
B.一种元素可能有多种氧化物,但同种化合价只对应一种氧化物
C.在化学反应中,一定有化学键的断裂和形成,并伴有能量的变化
D.熔融状态能导电的物质一定是离子化合物
难度: 中等查看答案及解析
-
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示。若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )
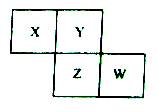
A.只由这四种元素不能组成有机化合物
B.最高价氧化物对应水化物的酸性W比Z弱
C.Z的单质与氢气反应较Y剧烈
D.X与Y形成的化合物都易溶于水
难度: 中等查看答案及解析
-
为提纯下列物质(括号内的物质是杂质),所选用的除杂试剂和分离方法都不正确的是( )
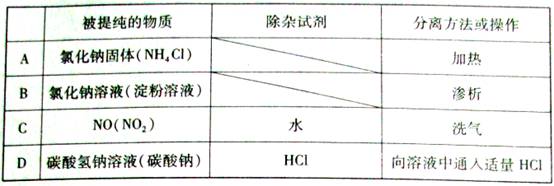
难度: 中等查看答案及解析
-
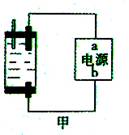
观察下列几个装置示意图,有关叙述正确的是( )
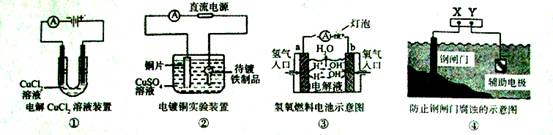
A.装置①中阳极上析出红色固体
B.装置②的待镀铁制品应与电源正极相连
C.装置③闭合电键后,外电路电子由a极流向b极
D.装置④的x电极是外接电源的正极
难度: 中等查看答案及解析
-
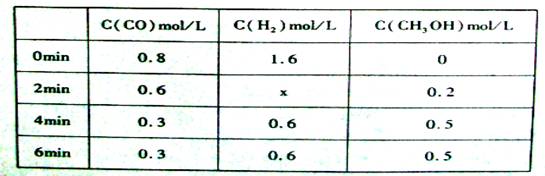
在容积固定的容器中发生反应:CO(g)+2H2(g)
CH3OH(g) △H<0,各物质的浓度如下表下列说法不正确的是( )
A. 2min-4min内用氢气表示的速率为0.3mol/(L•min)
B.达平衡时,CO的转化率为62.5%
C. 反应在第2min时改变了条件,可能是加入了催化刺
D. 反应在第2min时改变了条件,可能增加了H2的浓度
难度: 中等查看答案及解析
-
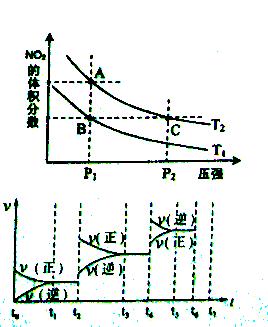
化学中常用图像直观地描述化学反应的进程或结果。下列图像描述正确的是( )
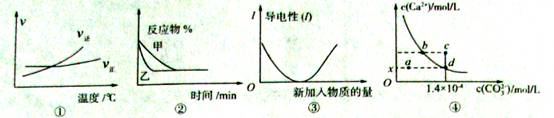
A.根据图①可判断可逆反应A2(g)+3B2(g)
2AB3(g)的△H>O
B.图②表示压强对可逆反应2A(g)+2B(g)
3C(g)+D(s)的影响,乙曲线表示的压强大
C.图③可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化
D.室温时,CaC03在水中的沉淀溶解平衡曲线如图④所示,c点时有CaC03生成
难度: 中等查看答案及解析
-
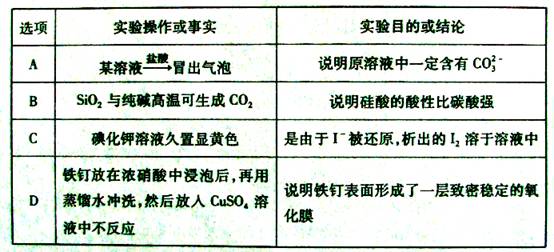
下列实验操作或事实与预期实验目的或所得结论一致的是( )
难度: 中等查看答案及解析
-
已知Cu+在酸性条件下能发生下列反应:Cu+
Cu+Cu2+(未配平)。
NH4CuS03与足量的lOmol·L-1硫酸溶液混合微热,产生下列现象:
①有红色金属生成;②有刺激性气味气体产生;③溶液呈蓝色。
据此判断下列说法一定合理的是( )
A.该反应显示硫酸具有酸性
B.NH4CuS03中铜元素全部被氧化
C.刺激性气味的气体是氨气
D.反应中硫酸作氧化剂
难度: 中等查看答案及解析