-
下列关于化学与生产、生活的认识不正确的是
A、使用清洁能源是防止酸雨发生的重要措施之一
B、CO2、CH4、N2等均是造成温室效应的气体
C、节能减排符合低碳经济的要求
D、合理开发利用可燃冰(固态甲烷水合物)有助于缓解能源紧缺
难度: 简单查看答案及解析
-
NA为阿伏伽德罗常数的值,下列叙述正确的是
A.常温常压下,11.2L 氮气所含的原子数目为NA
B.在反应3SiO2+6C+2N2 = Si3N4+6CO,生成1 mol Si3N4时共转移12 NA电子
C.1molNa2O2固体中含离子总数为4 NA
D.25℃时pH=13的NaOH溶液中含有Na+的数目为0.1NA
难度: 困难查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.pH=3的溶液中: Na+、NO3-、Fe2+、SO42-
B.加入铝粉能产生氢气的溶液中:NH4+、CH3COO-、SO42-、NO3-
C.某酸性溶液中Na+、ClO‾、SO42‾、I‾
D.在0.1mol·L-1 AlC13溶液中:H+、 Na+、 Cl-、 NO3-
难度: 中等查看答案及解析
-
下列装置进行相应的实验,能达到实验目的的是
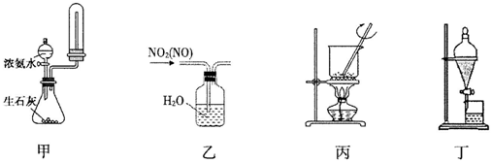
A.用装置甲制取并收集干燥纯净的NH3
B.用装置乙除去NO2中混有的少量NO
C.用装置丙将氢氧化钠固体加热熔
D.用装置丁把溴水中的溴萃取分离出来
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是
A.实验室用烧碱溶液除去尾气中的Cl2:Cl2+OH-=Cl-+HClO
B.稀硝酸中加入过量铁粉:Fe +4H++NO3-=Fe3++NO↑+2H2O
C、石灰水中加入过量小苏打溶液:2HCO3-+Ca2++2OH-=CaCO3↓+ CO32+2H2O
D、向NaAlO2溶液中通入过量CO2:2AlO2﹣+CO2+3H2O=2Al(OH)3↓+CO32﹣
难度: 中等查看答案及解析
-
下列有关说法正确的是
A.加热0.1mol/L Na2CO3溶液时,CO32-的水解程度和溶液的pH均增大
B.100℃时水的离子积常数Kw为5.5×10-13,说明水的电离是放热反应
C.若在海轮外壳上附着一些铜块,则可以减缓海轮外壳的腐蚀
D.0.1mol·L-1CH3COOH溶液加水稀释后,CH3COOH的电离程度和溶液中c(CH3COO-)的值增大
难度: 中等查看答案及解析
-
电解硫酸钠溶液联合生产硫酸和烧碱溶液的装置 如右下图所示,其中阴极和阳极均为惰性电极。测得同温同压下,气体甲与气体乙的体积比约为1︰2,以下说法不正确的是
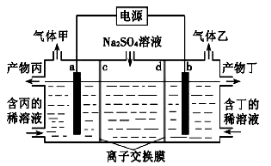
A.a极与电源的正极相连
B.产物丙为硫酸溶液
C.离子交换膜d为阳离子交换膜(允许阳离子通过)
D.a电极反应式为2H2O+2e-=2OH-+ H2↑
难度: 困难查看答案及解析
-
在酸性介质中,向MnSO4溶液中滴加(NH4)2S2O8(过二硫酸铵)溶液会发生如下离子反应:2Mn2++5S2O82﹣+8X=2MnO42﹣+10SO42﹣+16H+,下列说法正确的是
A.X是H2O
B.还原性:SO42﹣>Mn2+
C.该反应中酸性介质可以为盐酸
D.每生成0.1molSO42﹣,转移电子0.05mol
难度: 困难查看答案及解析
-
下列相关反应的离子方程式书写正确的是
A.将钠粒投入CuSO4溶液中:2Na+Cu2+=Cu+2Na+
B.将NaHSO4溶液滴加到含有酚酞的Ba(OH)2溶液中,溶液由红色变成无色:
Ba2++OH﹣+H++SO42﹣=BaSO4↓+H2O
C.硫化钠溶液中加入少量的氯化铁溶液:S2﹣+2Fe3+=2Fe2++S↓
D.将少量醋酸加入到NaAlO2溶液中:CH3COOH+AlO2﹣+H2O=CH3COO﹣+Al(OH)3↓
难度: 困难查看答案及解析
-
实验室某些物质的制备装置如图所示(省略夹持装置和净化装置),仅用此装置和表中提供的物质完成相关实验,最合理的是
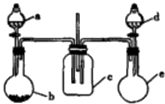
选项
a中的物质
b中的物质
c中的物质
d中的物质
d中的物质
A
浓硫酸
Na2SO3
(NH4)2SO3
浓氨水
CaO
B
浓硝酸
Cu
H2SO4
稀盐酸
Na2S
C
稀硫酸
Zn
HCl
稀盐酸
MnO2
D
浓硫酸
CH3CH2OH
CH2BrCH2Br
溴单质
CCl4
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
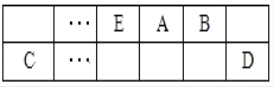
短周期主族元素X、Y、Z、W的原子序数依次增大,其中X是地壳中含量最多的元素.常温下,Y的块状单质在Z的最高价氧化物对应水化物的浓溶液中会发生钝化.下列说法正确的是
A.X与W位于同一主族
B.原子半径:X>Y
C.最简单氢化物的稳定性:X>Z
D.最高价氧化物对应水化物的酸性:Z>W
难度: 中等查看答案及解析
-
常温下,已知0.1mol/L的CH3COOH和HCN溶液的pH分别为a、b,且1<a<b,下列有关叙述不正确的是
A.CH3COOH与HCN均为弱酸
B.常温下,等浓度CH3COONa溶液的pH小于NaCN溶液的pH
C.在CH3COONa溶液中,c(Na+)+c(H+)=c(CH3COO﹣)+c(CH3COOH)
D.在NaCN溶液中,c(Na+)>c(CN﹣)
难度: 中等查看答案及解析
-
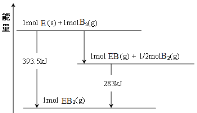
如图为以SCY陶瓷固体为电解质的电化学合成氨装置,将该装置的底部置于加热炉内保持570℃的高温.将氨气通往陶瓷内筒,将氢气通过陶瓷内筒和石英外筒间的空隙.下列说法正确的是
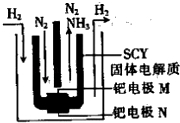
A.钯电极N为正极
B.钯电极M上发生氧化反应
C.SCY陶瓷固体电解质中H+移向钯电极N
D.电池总反应方程式为N2+3H2═2NH3
难度: 困难查看答案及解析
-
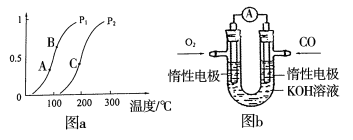
工业上消除氮氧化物的污染可用如下反应:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=akJ/mol.在温度T1和T2时,分别将0.50mol CH4和1.2mol NO2充入体积为1L的恒容密闭容器中,测得n(N2)随时间变化的数据如表.下列说法不正确的是
温度
时间/min
n/mol
0
10
20
40
50
T1
n(N2)
0[
0.20
0.35
0.40
0.40
T2
n(N2)
0
0.25
…
0.30
0.30
A.T1温度下,CH4的平衡转化率为50%
B.T1<T2
C.a<0
D.T2时反应的平衡常数大于T1时反应的平衡常数
难度: 困难查看答案及解析