-
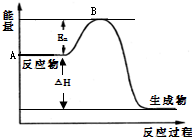
对于:2C4H10(g)+13O2(g)═8CO2(g)+10H2O(l);△H=-5800kJ/mol的叙述不正确的是( )
A.该反应的反应热为△H=-5800kJ/mol,是放热反应
B.该反应的△H与各物质的状态有关,与化学计量数也有关
C.该式的含义为:25℃、101kPa下,2molC4H10气体完全燃烧生成CO2和液态水时放出热量5800kJ
D.该反应为丁烷燃烧的热化学方程式,由此可知丁烷的燃烧热为5800kJ/mol难度: 中等查看答案及解析
-
下列说法或表示方法中正确的是( )
A.等质量的硫蒸气和硫固体分别完全燃烧,反应的热效应△H1>△H2
B.由C(石墨)→C(金刚石);△H=+1.9KJ/mol,可知1mol石墨的总键能比1mol金刚石的总键能大1.9kJ,即金刚石比石墨稳定
C.在101KPa时,2gH2完全燃烧生成液态水,放出285.8KJ热量,氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l);△H=+285.8KJ/mol
D.在稀溶液中:H+(aq)+OH-(aq)=H2O(l);△H=-57.3KJ/mol,若将0.5mol浓H2SO4溶液与含1molNaOH的溶液混合,放出的热量大于57.3KJ难度: 中等查看答案及解析
-
下列各变化中,属于原电池反应的是( )
A.在空气中金属铝表面迅速氧化形成保护层
B.镀锌铁表面有划损时,也能阻止铁被氧化
C.红热的铁丝与冷水接触,表面形成蓝黑色保护层
D.浓硝酸比稀硝酸更容易氧化金属铜难度: 中等查看答案及解析
-
已知反应A+3B⇌2C+D在某段时间内以A的浓度变化表示的化学反应速度为1mol•L-1•min-1,则此段时间内以C的浓度变化表示的化学反应速率为( )
A.0.5mol•L-1•min-1
B.1mol•L-1•min-1
C.2mol•L-1•min-1
D.3mol•L-1•min-1难度: 中等查看答案及解析
-
设C+CO2⇌2CO;△H>0,反应速率为v1;N2+3H2⇌2NH3;△H<0,反应速率为v2,对于上述反应,当温度升高时,v1和v2的变化情况为( )
A.同时增大
B.同时减小
C.v1增大,v2减小
D.v1减小,v2增大难度: 中等查看答案及解析
-
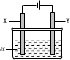
如图所示,U形管中装入含有紫色石蕊的Na2SO4试液,通直流电,一段时间后U形管内会形成三色“彩虹”的现象,它从左到右颜色的次序是( )
A.蓝、紫、红
B.红、蓝、紫
C.红、紫、蓝
D.蓝、红、紫难度: 中等查看答案及解析
-
用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加大的是( )
A.加热
B.不用稀硫酸,改用98%的浓硫酸
C.滴加少量CuSO4溶液
D.不用铁片,改用铁粉难度: 中等查看答案及解析
-
下列热化学方程式书写正确的是( )
A.2SO2+O22SO3;△H=-196.6kJ/mol
B.N2(g)+2O2(g)═2NO2(g);△H=+67.7kJ/mol
C.C(s)+O2(g)═CO2(g);△H=+393.5kJ/mol
D.H2O(l)═H2(g)↑+O2(g)↑;△H=+285.8kJ
难度: 中等查看答案及解析
-
下列描述中,不符合生产实际的是( )
A.电解熔融的氧化铝制取金属铝,用铁作阳极
B.电解法精炼粗铜,用纯铜作阴极
C.电解饱和食盐水制烧碱,用涂镍碳钢网作阴极
D.在镀件上电镀锌,用锌作阳极难度: 中等查看答案及解析
-
有两只串联的电解池(Pt为电极),甲池盛有足量的CuSO4溶液,乙池盛有足量的某硝酸盐的稀溶液.电解时当甲池电极析出6.4gCu时,乙池电极析出21.6g金属,则乙池的溶质可能是( )
A.NaNO3
B.Cu(NO3)2
C.Al(NO3)3
D.AgNO3难度: 中等查看答案及解析
-
在密闭容器中进行可逆反应,A与B反应生成C,其反应速率分别用υ(A) υ(B)、υ(C)表示,且υ(A)、υ(B)、υ(C)之间有如下所示关系:υ(B)=3υ(A);3υ(C)=2υ(B).则此反应可表示为( )
A.2A+3B=2C
B.A+3B=2C
C.3A+B⇌2C
D.A+3B⇌2C难度: 中等查看答案及解析
-
已知H2(g)+Br2(l)=2HBr(g);△H=-72kJ/mol.蒸发1mol Br2(l)需要吸收的能量为30kJ,其它相关数据如下表:
则表中a为( )H2(g) Br2(g) HBr(g) 1mol分子中的化学键断裂时
需要吸收的能量/KJ436 a 369
A.404
B.260
C.230
D.200难度: 中等查看答案及解析
-
在铁的电化学腐蚀中,发生还原反应的那个电极上进行的电极反应是( )
A.2H2O+O2+4e-═4OH-
B.2H++2e-═H2
C.4OH--4e-═2H2O+O2
D.Fe-2e-═Fe2+难度: 中等查看答案及解析
-
下列有关判断正确的是( )
A.由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Cu-2e-=Cu2+
B.由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3e-+3OH-=Al(OH)3
C.由Al、Cu、浓硝酸组成原电池,其负极反应式为:Cu-2e-=Cu2+
D.用原电池和电解池装置都能实现2HCl+Cu=CuCl2+H2↑反应难度: 中等查看答案及解析
-
中和热测定实验中,用50mL0.50mol/L盐酸和50mL0.55mol/LNaOH进行实验,下列说法不正确的是( )
A.改用60mL0.50mol/L盐酸跟50mL0.55mol/LNaOH溶液进行反应,求出的中和热数值和原来相同
B.用50mL0.50mol/L盐酸和50mL0.55mol/LNaOH进行实验比用50mL0.50mol/L盐酸和50mL0.50mol/LNaOH测得的数值准确
C.酸碱混合时,量筒中NaOH溶液应缓缓倒入小烧杯中,不断用玻璃棒搅拌
D.装置中的大小烧杯之间填满碎泡沫塑料的作用是保温隔热、减少热量损失难度: 中等查看答案及解析
-
镍镉电池在通讯、交通及日常生活中有着广泛的应用,其工作原理可以表示为:Cd+2NiO(OH)+2H2O
2Ni(OH)2+Cd(OH)2以下说法中正确的是( )
A.以上反应是可逆反应
B.放电时,镉为正极
C.充电时电池上标有“+”号的电极连接电源负极
D.以镍镉电池为电源,电解Na2CO3溶液,当收集到气体的总体积为33.6L(标况下)时,电池中转移了2mol电子难度: 中等查看答案及解析