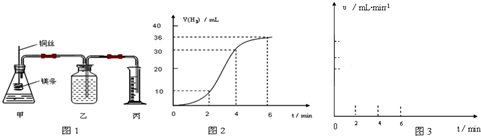
-
用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加大的是( )
A.加热
B.不用稀硫酸,改用98%的浓硫酸
C.滴加少量CuSO4溶液
D.不用铁片,改用铁粉难度: 中等查看答案及解析
-
下列关于燃料充分燃烧的说法,不正确的是( )
A.空气量越多越好
B.应通入适量的空气
C.固体燃料燃烧前要粉碎
D.液体燃料燃烧时可以以雾状喷出难度: 中等查看答案及解析
-
下列各组中,性质比较不正确的是( )
A.酸性:HClO4>HBrO4>HIO4
B.碱性:NaOH>Mg(OH)2>Al(OH)3
C.稳定性:PH3>H2S>HCl
D.非金属性:F>O>S难度: 中等查看答案及解析
-
对于可逆反应2SO2+O2⇌2SO3,在混合气体中充入一定量的18O2,足够长的时间后,18O原子( )
A.只存在于O2中
B.只存在于O2和SO3中
C.只存在于O2和SO2中
D.存在于O2、SO2和SO3中难度: 中等查看答案及解析
-
石油、煤、天然气等在地球上的蕴藏量是有限的,为缓解能源危机:①可以利用电解水的方法得到氢气做能源;②利用生物能制酒精做能源;③砍伐树木做能源;④应开发太阳能、核能等新能源.上述说法正确的是( )
A.只有①
B.①和④
C.②和④
D.④难度: 中等查看答案及解析
-
NO和CO都是汽车尾气中的有害物质,它们能缓慢地反应生成氮气和二氧化碳,对此反应,下列叙述正确的是( )
A.使用适当的催化剂不改变反应速率
B.降低压强能提高反应速率
C.升高温度能提高反应速率
D.改变压强对反应速率无影响难度: 中等查看答案及解析
-
下列关于实验室制取气体所用试剂的组合不合理的是( )
A.制Cl2:MnO2、盐酸(浓)
B.制H2:硫酸(稀)、Zn
C.制O2:MnO2、H2O2
D.制CO2:硫酸(稀)、CaCO3难度: 中等查看答案及解析
-
对反应A+3B⇌2C来说,下列反应速率最快的是( )
A.v(A)=0.3mol/
B.v(B)=0.6mol/
C.v(C)=0.5mol/
D.v(A)=0.01mol/难度: 中等查看答案及解析
-
将盐酸滴到碳酸钠粉末上,能使反应的最初速率加快的是( )
A.盐酸浓度不变,使用量增大1倍
B.盐酸浓度增加1倍,用量减至
C.增大碳酸钠粉末的用量
D.使反应在较低温度下进行难度: 中等查看答案及解析
-
一定温度下,反应N2(g)+3H2(g)⇌2NH3(g)达到化学平衡状态的标志是( )
A.N2、H2和NH3的浓度不再改变
B.c(N2):c(H2):c(NH3)=1:3:2
C.N2与H2的物质的量之和是NH3的物质的量2倍
D.单位时间里每增加1molN2,同时增加3molH2难度: 中等查看答案及解析
-
已知破坏1mol H-H键、Cl-Cl键分别需要吸收436kJ、243kJ、断裂1mol H-Cl键要吸收432kJ能量,则由H2与Cl2生成1mol HCl总的过程需要( )
A.放热185kJ
B.吸热185kJ
C.放热92.5kJ
D.吸热92.5kJ难度: 中等查看答案及解析
-
A、B、C三种元素的原子序数依次为a、b、c,它们的离An+、Bn-、Cm-具有相同的电子层结构,且n>m,则下列关系正确的是( )
A.a>b>c
B.a>c>b
C.a=b+m-n
D.a=c-n-m难度: 中等查看答案及解析
-
下列电子式书写错误的是( )
A.
B.
C.
D.难度: 中等查看答案及解析
-
下图各装置中,不能形成原电池的是(烧杯中所盛液体都是稀硫酸)( )
A.
B.
C.
D.难度: 中等查看答案及解析
-
锂电池是一代新型高能电池,它以质量轻、能量高而受到了普遍重视,目前已研制成功多种锂电池. 某种锂电池的总反应式是Li+MnO2=LiMnO2.下列说法正确的是( )
A.Li是负极,电极反应为Li-e-=Li+
B.Li是正极,电极反应为Li+e-=Li-
C.MnO2是负极,电极反应为MnO2+e-=MnO2-
D.锂电池是一种非环保型电池难度: 中等查看答案及解析
-
把镁条投入到盛有盐酸的敞口容器里,产生H2的速率可由右图表示.在下列因素中:①盐酸的浓度;②镁条的表面积;③溶液的温度;④Cl-的浓度.影响反应速率的因素是( )
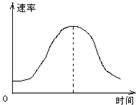
A.①④
B.③④
C.①②③
D.②③难度: 中等查看答案及解析
-
有下列物质:①NaOH固体:②浓硫酸;③NH4N03晶体;④CaO固体.现将它们分别装入有水的锥形瓶里,立即塞紧带U形管的塞子,发现U形管内滴有红墨水的水血.呈形如图所示状态,判断加入的物质可能是( )
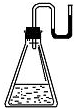
A.①②③④
B.①②④
C.②③④
D.①②③难度: 中等查看答案及解析
-
如图所示,各烧杯中均盛有海水,铁在其中被腐蚀由快到慢的顺序为( )
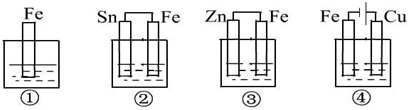
A.②①③④
B.④③①②
C.④②①③
D.③②④①难度: 中等查看答案及解析