-
(12分)A、B、C、D、E代表5种元素。请填空:
(1)A元素基态原子的最外层有2个未成对电子,次外层有2个电子,其元素符号为_______;
(2)B元素的负一价离子和C元素的正一价离子的电子层结构都与氖相同,B的元素符号为________,C的元素符号为________;
(3)D元素的正二价离子的3d能级为半充满,D的元素符号为________,其基态原子的电子排布式为_________ _____,它位于第______周期第______族;
(4)E元素基态原子的M层能量最高的能级半充满,N层没有成对电子,只有一个未成对电子,E的元素符号为________,其基态原子的电子排布式为________ ______。
难度: 简单查看答案及解析
-
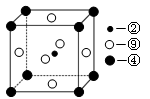
(13分)下表为长式周期表的一部分,其中的编号代表对应的元素。
请回答下列问题:
(1)元素⑩的基态原子的价电子排布式为________。
(2)科学发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如图所示(图中②、④、⑨分别位于晶胞的体心、顶点、面心),则该化合物的化学式为________(用对应的元素符号表示),与④距离相等且最近的⑨有________个。
(3)元素②的一种氢化物(分子中含有6个原子)是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志。有关该氢化物分子的说法正确的是________。
A.分子中含有分子间的氢键
B.属于含有极性键的非极性分子
C.只含有4个sp1-s的σ键和1个p-p的π键
D.该氢化物分子中②原子采用sp2杂化
(4)下图所示为血红蛋白和肌红蛋白的活性部分(血红素)的结构式。此结构片段中含有的化学键有________(填序号)。
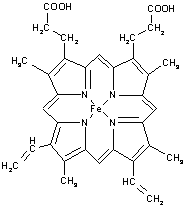
A.离子键 B.金属键 C.极性键 D.非极性键
E.配位键 F.氢键 G.σ键 H.π键
(5)下表为原子序数依次增大的短周期元素A~F的第一到第五电离能数据。

请回答:表中的金属元素是________(填字母);若A、B、C为原子序数依次增大的同周期相邻元素,表中显示B比A和C的第一电离能都略大,其原因是________
________。
难度: 简单查看答案及解析
-
(6分)原子序数小于36的X、Y、Z、W四种元素,其中X元素的原子是半径最小的原子,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29。回答下列问题:
(1)Y2X2分子中Y原子轨道的杂化类型为________,1mol Y2X2含有σ键的数目为________。
(2)化合物ZX3的沸点比化合物YX4的高,其主要原因是________。
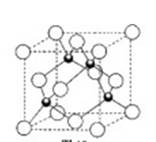
(3)元素W的一种氯化物晶体的晶胞结构如图所示,该氯化物的化学式是________,它可与浓盐酸发生非氧化还原反应,生成配合物HnWCl3,反应的化学方程式为________。
难度: 简单查看答案及解析
-
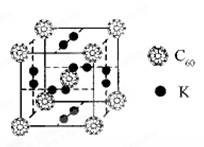
(9分)氢气作为一种清洁能源,必须解决它的储存问题, C60可用作储氢材料。
(1)已知金刚石中C—C键的键长为154.45 pm,C60中C—C键的键长为145 pm和140 pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确并阐述理由____________________________ ______。
(2)科学家把C60和K掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示,该物质在低温时是一种超导体。该物质中K原子和C60分子的个数比为______________________。
(3)继C60后,科学家又合成Si60、N60,C、Si、N原子电负性由大到小的顺序是__________________。Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为__________。
难度: 简单查看答案及解析
-
(9分)氮化硼(BN)是一种重要的功能陶瓷材料。以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示:
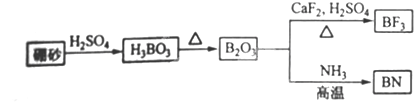
请回答下列问题:
(1)由B2O3制备BN、BF3的化学方程式依次是_________________、
__________;
(2)BF3和过量NaF作用可生成NaBF4,BF4-的立体结构为_______________;
(3)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为_ ___ __________,层间作用力为________________;
(4)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm,立方氮化硼的密度是_______________g·cm-3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
难度: 简单查看答案及解析
-
(11分) 铬同镍、钴、铁等金属可以构成高温合金、电热合金、精密合金等,用于航空、宇航、电器及仪表等工业部门。
(1)钴原子的基态电子排布式为_____________________ _____________。
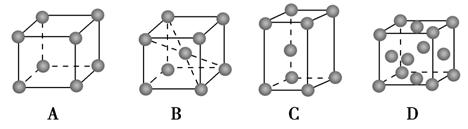
(2)金属铬的堆积方式属于A2型,其晶胞示意图为________(填序号)。
(3)氯化铬酰(CrO2Cl2)常温下为暗红色液体,熔点-96.5 ℃,沸点117 ℃,能与丙酮(CH3COCH3)、CCl4、CS2等互溶。
①固态CrO2Cl2属于________________晶体;
②丙酮中碳原子采取的杂化方式为___;
③CS2属于________________________(填“极性”或“非极性”)分子。
(4)+3价铬的配合物K[Cr(C2O4)2(H2O)2]中,配体是________________,与C2O42—互为等电子体的分子是(填化学式)________________。
(5)CrCl3·6H2O(相对分子质量为266.5)有三种不同颜色的异构体:[Cr(H2O)6]Cl3、[Cr(H2O)5Cl]Cl2·H2O和[Cr(H2O)4Cl2]Cl·2H2O。为测定蒸发CrCl3溶液析出的暗绿色晶体是哪种异构体,取2.665 g CrCl3·6H2O配成溶液,滴加足量AgNO3溶液,得到沉淀1.435 g。该异构体为____________________(填化学式)。
难度: 简单查看答案及解析