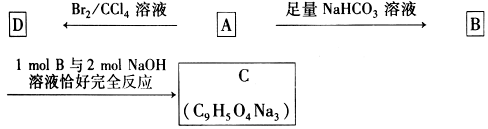
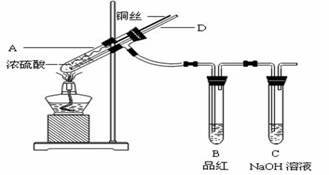
-
在一定条件下,分别以高锰酸钾、氯酸钾和过氧化氢为原料制取氧气,当制得同温同压下相同体积的氧气时,三个反应中转移的电子数之比为( )
A.1∶1∶1 B.4∶3∶2
C.2∶3∶1 D.2∶2∶1
难度: 中等查看答案及解析
-
镁粉在焰火、闪光粉、鞭炮中是不可缺少的原料,工业制造镁粉是将镁蒸气在某冷却剂中冷却,下列可作为冷却剂的是( )
①CO2 ②O2 ③Ar ④H2 ⑤N2 ⑥Cl2
A.①② B.③④ C.③⑥ D.③⑤
难度: 中等查看答案及解析
-
下列说法中正确的是 ( )
A.氯化钠水溶液在电流的作用下电离出Na+和Cl-
B.硫酸钡难溶于水,但硫酸钡属于强电解质
C.二氧化碳溶于水能部分电离,故二氧化碳属于弱电解质
D.硫酸钠在水中的电离方程式可表示为Na2SO4===2Na++S6++4O2-
难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数的值,下列说法正确的是( )
A. 5.6 g铁粉在0.1mol氯气中充分燃烧,转移电子数为0.3NA
B.1 mol Na2O2与足量H2O充分反应,转移的电子数为2NA
C.7.8gNa2O2中含有的阴离子数等于0.1NA
D.0.5mol雄黄(As4S4,结构如右图)含有NA个S—S键
难度: 中等查看答案及解析
-
同位素示踪法可用于反应机理的研究,下列反应或转化中同位素示踪表示正确的是( )
A.2Na218O2 + 2H2O = 4Nal8OH + O2↑
B.2KMnO4 + 5H218O2 + 3H2SO4 = K2SO4 + 2MnSO4 + 518O2↑+ 8H2O
C.NH4Cl + 2H2O
NH3·2H2O + HCl
D.K37ClO3 + 6HCl = K37Cl + 3Cl2↑+ 3H2O
难度: 中等查看答案及解析
-
2007年3月温家宝总理在十届全国人大五次会议上提出“要大力抓好节能降耗、保护环境”,下列举措中违背了这一指导思想的是 ( )
A.加大开发太阳能、水能、风能、地热能等能源力度,减少化石燃料的使用
B.研制乙醇汽油技术,降低机动车辆尾气中有害气体排放
C.生产、生活中,努力实现资源的循环利用
D.利用高新技术,提高石油、煤、天然气产量,以满足工业生产快速发展的需求
难度: 中等查看答案及解析
-
下列关于有机物的说法正确的是( )
A.乙醇、乙烷和乙酸都可以与钠反应生成氢气
B.75%(体积分数)的乙醇溶液常用于医疗消毒
C.苯和乙烯都可使溴的四氯化碳溶液褪色
D.石油分馏可获得乙酸、苯及其衍生物
难度: 中等查看答案及解析
-
右图是某有机分子的比例模型,黑色的是碳原子,白色的是氢原子,灰色的是氧原子。对该物质下列说法正确的是( )

A.该物质的水溶液可除去水瓶胆中的水垢。
B.该物质是室内装潢的夹板中散发出一种对人体有害气体。
C.它与乙醇混合加热就能产生具有水果香味的物质
D.该物质属电解质,在熔融状态下可导电。
难度: 中等查看答案及解析
-
分子式为C4H10O并能与金属钠反应放出氢气的有机化合物有:( )
A.3种 B.4种 C.5种 D.6种
难度: 中等查看答案及解析
-
2008年北京奥运会的“祥云”火炬所用的燃料的主要成分是丙烷,下列有关丙烷的叙述中不正确的是( )
A.分子中碳原子不在一条直线上 B.光照下能够发生取代反应
C.比丁烷更易液化 D.是石油分馏的一种产品
难度: 中等查看答案及解析
-
对于某些离子的检验及结论一定正确的是( )
A、加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32-
B、加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42-
C、加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+
D、加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+
难度: 中等查看答案及解析
-
下列有关贮存方法的叙述错误的是( )
A.浓硝酸用棕色瓶盛放,贮存在阴凉处
B.少量液溴可用水封存,防止溴挥发
C.氢氧化钠溶液贮存在带磨口玻璃塞的玻璃试剂瓶中
D.FeSO4溶液存放在加有少量铁粉的试剂瓶中
难度: 中等查看答案及解析
-
下列叙述不正确的是( )
A.铜具有良好的导电性,常用来制作印刷电路板
B.硅和二氧化硅都是重要的半导体材料
C.铝制品不宜长时间盛放酸性或碱性食物
D.氯水和过氧化钠都具有漂白作用,其漂白原理相同
难度: 中等查看答案及解析
-
下列说法中,正确的是( )
A.硅的化学性质不活泼,在自然界中可以以游离态存在
B. Na2O和Na2O2组成元素相同,且都能与硫酸溶液反应
C.工业上制备镁是用电解熔融的MgO来完成的
D. SO2通入新制氯水中,氯水退色是因为SO2具有漂白性
难度: 中等查看答案及解析
-
Al、Fe、Cu都是重要的金属元素。下列说法正确的是( )
A.三者对应的氧化物均为碱性氧化物
B.三者的单质放置在空气中均只生成氧化物
C.制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法
D.电解AlCl3、FeCl3、CuCl2的混合溶液时阴极上依次析出Cu、Fe、Al
难度: 中等查看答案及解析