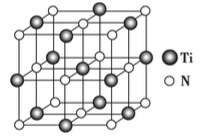
-
化学与生产、生活、社会密切相关。下列有关说法错误的是
A. 利用农作物秸秆制取乙醇 B. 回收地沟油,制备生物柴油
C. 焚烧废旧塑料,防止白色污染 D. 开发利用各种新能源,减少对化石燃料的依赖
难度: 简单查看答案及解析
-
下列有关化学用于表述正确的是
A. 质子数和中子数均为6的碳原子
C B. 溴化铵的电子式:
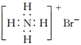
C. 氢氧化钠的电子式:
D. 2-丙醇的结构简式:
难度: 简单查看答案及解析
-
下列有关物质的性质与用途具有对应关系的是
性质
用途
A
液氨气化吸热
可用作制冷剂
B
NH4HCO3受热易分解
可用作氮肥
C
二氧化硅能与HF反应
可用作光导纤维
D
二氧化硫能使溴水褪色
可用作漂白剂
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下图是部分短周期主族元素原子半径与原子序数的关系图。下列说法错误的是
A. X、R的最高化合价相同
B. 简单离子的半径:X>Y>Z
C. Y、Z、R最高价氧化物对应水化物相互之间可以发生反应
D. 电解熔融的X与Z组成的化合物可以得到单质Z
难度: 中等查看答案及解析
-
下列反应的离子方程式书写不正确的是
A. 用氨水吸收过量的二氧化硫:NH3·H2O+SO2=HSO3-+NH4+
B. 用过氧化氢从酸化的海带灰浸出液中提取碘:2I-+H2O2+2H+ = I2+2H2O
C. 向NH4Al(SO4)2溶液中滴入Ba(OH) 2溶液恰好使SO42-完全沉淀:2Ba2+ + Al3+ + 2SO42- + 4OH- = AlO2- + 2BaSO4↓+ 2H2O
D. 向含0.1mol·L-1 Na2CO3和0.2mol·L-1 NaOH的混合溶液中加入等体积的0.15mol·L-1的硫酸:CO32-+3H++2OH- = 2H2O+HCO3-
难度: 困难查看答案及解析
-
巧妙的实验设计有助于更好地解决问题。下列装置不能达到实验目的的是
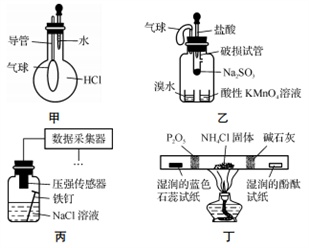
A. 用装置甲验证HCl气体易溶于水
B. 用装置乙验证SO2具有漂白性
C. 用装置丙采集到的压强数据判断铁钉发生析氢腐蚀还是吸氧腐蚀
D. 用装置丁检验NH4Cl分解产生的气体
难度: 中等查看答案及解析
-
下列说法正确的是
A. 铅蓄电池放电一段时间后,负极质量减小,正极质量增加
B. 298K时,2H2S(g)+SO2(g)=3S(s)+2H2O(l)能自发进行,则其ΔH<0
C. pH=3的盐酸与pH=11的某碱溶液等体积混合,溶液呈碱性,说明该碱为强碱
D. 标准状况下,22.4L甘油中含有3mol羟基(—OH)
难度: 中等查看答案及解析
-
在给定条件下,下列选项中所示的物质间转化均能一步实现的是
A.
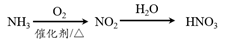
B.
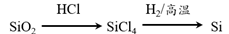
C.
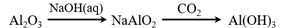
D.
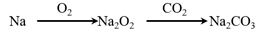
难度: 中等查看答案及解析
-
以N2和H2为反应物、溶有A的稀盐酸为电解质溶液,可制成能固氮的新型燃料电池,原理如下图所示。下列说法错误的是
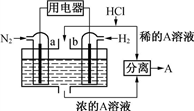
A. b电极为负极,发生氧化反应
B. a电极发生的反应为N2+8H++6e-=2NH4+
C. A溶液中所含溶质为NH4Cl
D. 当反应消耗1mol N2时,则消耗的H2为67.2L
难度: 中等查看答案及解析
-
H2与ICl的反应分①、②两步进行,其能量曲线如图所示,下列有关说法错误的是
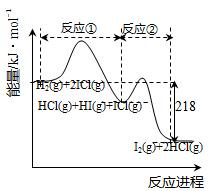
A. 反应①、反应②均为放热反应
B. 反应①、反应②均为氧化还原反应
C. 反应①比反应②的速率慢,与相应正反应的活化能无关
D. 反应①、反应②的焓变之和为ΔH=-218kJ·mol-1
难度: 简单查看答案及解析
-
合成药物异搏定路线中某一步骤如下:

下列说法错误的是
A. 物质X中所有碳原子可能在同一平面内
B. 可用FeCl3溶液鉴别Z中是否含有X
C. 等物质的量的X、Z 分别与H2加成,最多消耗H2的物质的量之比为3:5
D. 等物质的量的X、Y分别与NaOH反应,最多消耗NaOH的物质的量之比为1∶2
难度: 中等查看答案及解析
-
下列根据实验操作和现象所得出的结论正确的是
选项
实验操作及现象
结论
A
测定等物质的量浓度的Na2CO3和Na2SO3溶液的pH,前者pH比后者的大
非金属性:S>C
B
向苯酚浊液中滴加Na2CO3溶液,浊液变澄清
CO32-结合质子能力比C6H5O-强
C
向10 mL 0.2 mol·L-1NaOH溶液中滴入2滴0.1 mol·L-1MgCl2溶液,产生白色沉淀后,再滴加2滴0.1 mol·L-1FeCl3溶液,白色沉淀转化为红褐色沉淀
相同温度下的Ksp:Mg(OH)2>Fe(OH)3
D
将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡、静置,下层溶液显紫红色
Fe3+的氧化性大于I2
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
向实验室做完铝热反应(Al和氧化铁)后的混合物中,加入足量稀硫酸将其溶解,室温下向所得溶液中加入指定物质,反应后的溶液中主要存在的离子组正确的是
A. 通入过量Cl2: Cl-、Fe2+、SO42-、Al3+
B. 加入过量NaOH溶液:Na+、AlO2-、SO42-、OH-
C. 加入过量氨水:Na+、NH4+、SO42-、AlO2-
D. 加入过量铜粉:NO3-、Fe3+、SO42-、Al3+
难度: 中等查看答案及解析
-
25℃时,下列溶液中微粒的物质的量浓度关系正确的是
A. 0.1mol·L-1NaHC2O4溶液(pH=5.5):c(Na+)> c(HC2O4-)> c(H2C2O4)> c(C2O42-)
B. 0.1mol·L-1NaHS溶液:c(OH-)+ c(S2-)= c(H+)+ c(H2S)
C. 0.1mol·L-1CH3COOH溶液和0.1mol·L-1CH3COONa溶液等体积混合:c(Na+)> c(CH3COOH)> c(CH3COO-)> c(H+)> c(OH-)
D. 0.1mol·L-1NH4HSO4溶液中滴加0.1mol·L-1NaOH溶液至中性:c(Na+)> c(SO42-)>c(NH4+)> c(OH-)= c(H+)
难度: 中等查看答案及解析
-
一定温度下,在三个体积均为0.5 L的恒容密闭容器中发生反应:
CO(g)+Cl2(g)
COCl2(g)
其中容器Ⅰ中5 min时到达平衡。
容器编号
温度/℃
起始物质的量/mol
平衡物质的量/mol
CO
Cl2
COCl2
COCl2
Ⅰ
500
1.0
1.0
0
0.8
Ⅱ
500
1.0
a
0
0.5
Ⅲ
600
0.5
0.5
0.5
0.7
下列说法正确的是
A. 容器Ⅰ中前5 min的平均反应速率v(CO)=0.16 mol·L-1·min-1
B. 该反应的正反应为吸热反应
C. 容器Ⅱ中起始时Cl2的物质的量为0.55 mol
D. 若起始时向容器Ⅰ中加入CO 0.8 mol、Cl2 0.8 mol,达到平衡时CO的转化率大于80%
难度: 困难查看答案及解析
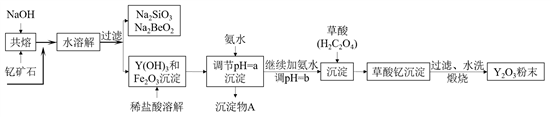
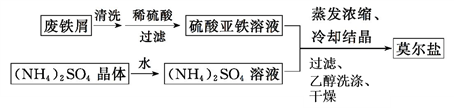
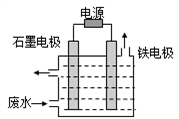
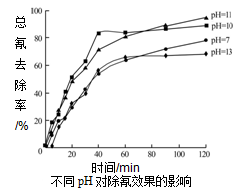
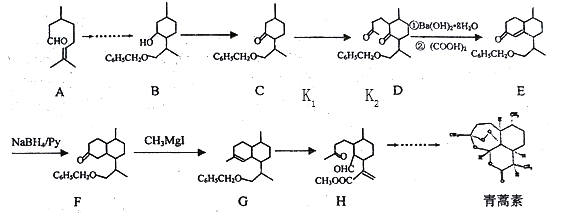
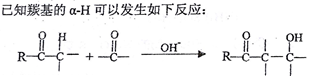
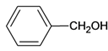 )和乙烯为原料(其他无机试剂任选),合成
)和乙烯为原料(其他无机试剂任选),合成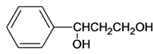 。__________________________
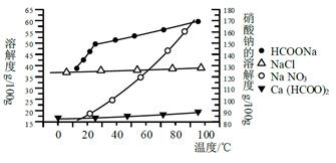
。__________________________
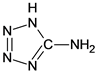 )中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊。
)中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊。