-
下列有关化学基本概念正确的是
A. 氧化还原的本质是存在电子的转移(得失或偏移)
B. 有单质参加的化学反应一定是氧化还原反应
C. 依据化合物在水溶液中的导电能力强弱,将化合物分为强电解质和弱电解质
D. 溶液与胶体的本质区别是否能产生丁达尔现象
难度: 简单查看答案及解析
-
下列说法正确的是

A. 萃取操作时,振荡过程中需要放气,放气是通过打开分液漏斗上口的玻璃塞进行的
B. 可以采用蒸发浓缩、冷却结晶的方法从硝酸钾溶液中获得硝酸钾晶体
C. 将乙醇与水分离,如图1、图2操作
D. 稀释浓H2SO4,如图3操作
难度: 简单查看答案及解析
-
下列仪器在使用之前需要检查是否漏液的是
①分液漏斗 ②容量瓶 ③长颈漏斗 ④蒸馏烧瓶
A. ①② B. ①②③ C. ②③④ D. ①②③④
难度: 简单查看答案及解析
-
下列溶液中的c (Cl-)与100mL 1mol·L-1 氯化铝溶液中的c (Cl-)相等
A. 300ml 1mol·L-1 氯化钠溶液 B. 150ml 2mol·L-1 氯化铵溶液
C. 75ml 3mol·L-1 氯化钙溶液 D. 120ml 1.5mol·L-1 氯化镁溶液
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是
A. 常温常压下,0.1molCl2溶于水,Cl2与水发生反应转移的电子数目为0.1NA
B. 常温常压下,0.2molAl与足量NaOH溶液反应,转移电子数为0.6 NA
C. 常温常压下,500 mL 0.1mol/L醋酸溶液中含有分子的总数目为0.05NA
D. 常温常压下,16g CH4与18 g NH4+ 所含质子数相等
难度: 简单查看答案及解析
-
下列反应中,水既不作氧化剂,亦不作还原剂的氧化还原反应为
A. H2O+CaO=Ca(OH)2 B. 2F2+2H2O=4HF+O2
C. Cl2+H2O
HCl+HClO D. 2Na+2H2O=2NaOH+H2↑
难度: 简单查看答案及解析
-
下列各组中的离子,能在溶液中大量共存的是
A. K+、H+、SO42-、ClO- B. K+、Mg2+、CO32-、NO3-
C. Na+、Fe3+、Cl-、I- D. Na+、Cu2+、Cl-、SO42-
难度: 简单查看答案及解析
-
下列叙述中,正确的是
A. 含金属元素的离子一定都是阳离子
B. 现代化学分析测试中,常借助一些仪器来分析化学物质组成。例如,可用元素分析仪确定C、H、O等元素,用红外光谱仪确定物质中的有机原子团,用原子吸收光谱确定物质中含有哪些非金属元素
C. 某元素从化合态变为游离态时,该元素一定被还原
D. 金属阳离子被还原不一定得到金属单质
难度: 简单查看答案及解析
-
下列有关物质检验或鉴别的说法正确的是 ①检验某未知溶液中是否含有SO42-,通常是先向试液中滴加适量稀盐酸,然后再滴加BaCl2溶液;②鉴别氯化钠溶液和氯化钾溶液时,常用玻棒分别蘸取试液放在火焰上灼烧,直接观察火焰的颜色;③向某溶液中加入稀氢氧化钠溶液,若末嗅到氨的气味,则说明该溶液中无铵盐;④某白色固体与强酸溶液接触产生大量无色气体,则该固体一定是碳酸钙;⑤鉴别胶体与溶液最好的方法是观察有无“丁达尔现象”。
A. ①② B. ②③ C. ①⑤ D. ④⑤
难度: 简单查看答案及解析
-
下列示意图中,白球代表氢原子,黑球代表氦原子,方框代表容器,容器中间有一个可以上下滑动的隔板(其质量忽略不计)。其中能表示等质量的氢气与氦气的是
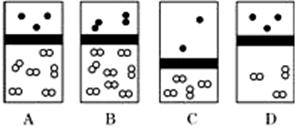
难度: 简单查看答案及解析
-
下列说法正确的是
A. 焰色反应实验后,用稀硫酸洗净铂丝,灼烧至无色,以除去残留在铂丝上的试剂
B. 某溶液中加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,则该溶液一定含有Ag+
C. 欲除去氯气中少量氯化氢气体,可将此混合气体通过盛饱和食盐水的洗气瓶
D. 托盘天平称取58.50g食盐,加1升水配制成溶液,NaCl溶液浓度为1mol·L-1
难度: 简单查看答案及解析
-
要验证Mg、Fe、Cu三种金属的活动性顺序,可选用下列哪组物质进行实验
A. Fe、CuSO4溶液、MgCl2溶液 B. Fe、MgCl2溶液、FeCl2溶液
C. Mg、CuO、FeSO4溶液 D. Cu、FeCl2溶液、MgCl2溶液
难度: 简单查看答案及解析
-
下表为各物质中所含的杂质以及除去这些杂质选用的试剂或操作方法,正确的一组是
物质
杂质
除杂试剂或操作方法
①
酒精
水
蒸馏
②
H2
CO2
通过盛有NaOH溶液洗气瓶,再通过盛有浓硫酸洗气瓶
③
NaNO3
CaCO3
溶解、过滤、蒸发
④
NaCl
I2
加热
⑤
KNO3溶液
AgNO3
加入NaCl溶液,过滤
A. ① ④ ⑤ B. ③ ④ ⑤ C. ① ② ③ ④ D. ① ② ③ ⑤
难度: 简单查看答案及解析
-
根据
(1)Fe+Cu2+=Fe2++Cu (2)2Fe3++Cu=Cu2++2Fe2+
(3)2Fe2++Cl2=2Fe3++2Cl- (4)HClO+H++Cl-=H2O+Cl2,
可以判断出各粒子的氧化性由强到弱的顺序正确的是
A. HClO>Cl2>Fe3+>Cu2+ B. Cl2>HClO>Fe3+>Cu2+
C.Cl2>Fe3+>HClO>Cu2+ D. HClO>Cl2>Cu2+>Fe3+
难度: 简单查看答案及解析
-
下列离子方程式正确的是
A.用FeCl3溶液腐蚀印刷电路板:Fe3++Cu=Fe2++Cu2+
B. 惰性电极电解氯化钠溶液:2Cl- +2 H2O
Cl2 ↑+H2 ↑+2OH—
C. Ca(HCO3)2与过量Ca(OH)2溶液反应:Ca2++HCO3-+2OH-=CaCO3↓+CO32- +2H2O
D. 向Fe(OH)3悬浊液中加入醋酸:Fe(OH)3+3H+=Fe3++3H2O
难度: 简单查看答案及解析
-
某氯原子的质量为a g , C-12原子的质量为b g,用NA表示阿伏加德罗常数,下列说法中不正确的是
A. 则该氯原子构成氯分子的相对分子质量为
B. 1 mol该氯原子的质量为aNA g
C. m g该氯原子的物质的量为
mol
D. n g该氯原子所含的电子数为
难度: 简单查看答案及解析
-
下列关于碳酸钠和碳酸氢钠的比较中,正确的是
A. 相同温度下,在水中,碳酸氢钠的溶解度大于碳酸钠的溶解度
B. 将石灰水加入碳酸氢钠溶液中不产生沉淀,加入碳酸钠溶液中产生白色沉淀
C. 将100 mL 0.10 mol/L盐酸溶液分别逐滴滴入到10 mL 1.00 mol/L的碳酸钠溶液或10 mL 1.00 mol/L碳酸氢钠溶液中,两者都能放出二氧化碳气体,但碳酸氢钠与酸反应产生二氧化碳的剧烈程度明显强于碳酸钠
D. 在一定温度下,物质的量浓度相同时,碳酸氢钠溶液的碱性弱于碳酸钠溶液
难度: 简单查看答案及解析
-
Na2FeO4是一种高效多功能水处理剂,应用前景十分看好。一种制备Na2FeO4的方法可用化学方程式表示如下:
2FeSO4 + 6Na2O2 = 2Na2FeO4 + 2Na2O + 2Na2SO4 + O2↑,对此反应下列说法中正确的是
A. Na2O2只作氧化剂
B. Na2FeO4既是氧化产物又是还原产物
C. O2 是还原产物
D. 2 mol FeSO4发生反应时,反应中共有8 mol电子转移
难度: 简单查看答案及解析
-
某溶液中只可能含有下列离子中的几种:Na+、NH4+、Cl-、SO42-、CO32-(不考虑少量的H+与OH-),分别取100mL该溶液进行以下实验:①若加入足量的烧碱并加热,产生224mL(标准状况下)气体;②若先加入足量的HNO3无现象,再加入足量的Ba(NO3)2,得到2.33g固体。则该溶液
A. 肯定含有NH4+、SO42-、Cl-,且c(SO42-)=0.1mol/L
B. 可能含有Na+和Cl-
C. 一定含有Na+,且c(Na+)≥0.1mol/L
D. 一定不含CO32-和Cl-
难度: 简单查看答案及解析
-
下列示意图与对应的反应情况正确的是
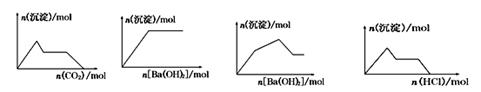
A B C D
A. 含0.01 mol KOH和0.01 mol Ca(OH)2的混合溶液中缓慢通入CO2
B. NaHSO4溶液中逐滴加入Ba(OH)2溶液
C. KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液
D. NaAlO2溶液中逐滴加入盐酸
难度: 简单查看答案及解析

