-
中国历史悠久,很早就把化学技术应用到生产生活中。下列与化学有关的说法不正确的是
A. 闻名世界的中国陶瓷、酿酒都充分应用了化学工艺
B. 黑火药是我国古代四大发明之一,配方为“一硫二硝三木炭“,其中的硝是指硝酸
C. 侯氏制碱法的工艺过程中应用了物质溶解度的差异
D. “绿水青山就是金山银山”,矿物燃料经过脱硫脱硝处理,可以减少SO2、NO2的排放
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的数值,下列说法正确的是
A. 1L 0.1mol·L-1NaHSO3溶液中含有H+的数目为NA个
B. 常温常压下,等质量的CO2和N2O的气体体积相等
C. 60g组成为C2H4O2的有机物含C-H键数目一定为3NA个
D. 25℃时,pH=1的H3PO4溶液中含有的H+数目为0.1NA
难度: 中等查看答案及解析
-
分子式为C9H12的芳香化合物,苯环上只有一个支链,则其苯环上的一氯代物共有多少种(不含立体结构)
A. 3种 B. 4种 C. 5种 D. 6种
难度: 中等查看答案及解析
-
化学在生活中有着广泛的应用,下列对应关系错误的是( )
化学性质
实际应用
A
铁粉具有还原性
袋装食品的抗氧剂
B
铁离子的氧化性比铜离子强
FeCl3溶液腐蚀Cu刻制印刷电路板
C
Na2O2能与CO2反应生成氧气
呼吸面具中的氧气来源
D
SO2具有漂白性
豆芽菜、银耳等食品的漂白
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
如图为镁--次氯酸盐燃料电池的工作原理图,下列有关说法不正确的是
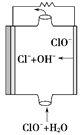
A. 该燃料电池中镁为负极,发生还原反应
B. 电池的总反应式为Mg+ClO-+H2O===Mg(OH)2↓+Cl-
C. 放电过程中OH-移向负极
D. 酸性电解质的镁--过氧化氢燃料电池正极反应为:H2O2+2H++2e-===2H2O
难度: 中等查看答案及解析
-
短周期元素中:A是地壳中含量最高的元素;B比Ne的质子数多1个;C最外层电子数与其电子层数相等;D单质是半导体材料;E非金属性在同周期元素中最强。下列说法中正确的是
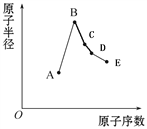
A. B离子的半径比C离子的半径小
B. C单质与A或E单质形成的化合物均为离子化合物
C. A、B两单质反应可得到两种不同的离子化合物
D. B最高价氧化物对应的水化物与0.1mol D单质充分反应放出4.48L气体
难度: 中等查看答案及解析
-
常温下,HX溶液、HY溶液、HY和NaY的混合溶液,分别加水稀释,稀释后溶液的pH随浓度的变化如图所示,下列叙述正确的是

A. HX、HY均为一元强酸
B. 溶液中水的电离程度:a = b < c
C. 常温下,HY的电离常数Ka约为1.0×10-4
D. c点溶液:c(Na+)>c(Y-)>c(HY) >c(H+)>c(OH-)
难度: 困难查看答案及解析









 (羟醛缩合反应)
(羟醛缩合反应) )在上述条件下,发生类似Ⅱ的反应产生互为同分异构体的两种有机物,写出它们的结构简式______________________________、_______________________________。
)在上述条件下,发生类似Ⅱ的反应产生互为同分异构体的两种有机物,写出它们的结构简式______________________________、_______________________________。 的合成路线_____________。
的合成路线_____________。