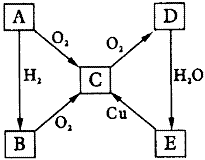
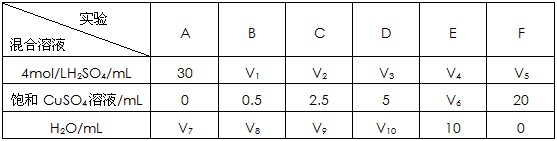
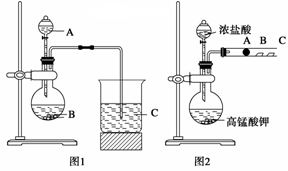
-
下列反应既属于氧化还原反应,又是吸热反应的是( )
A.天然气在空气中燃烧的反应 B.灼热的木炭与CO2的反应
C.铁粉与稀硫酸的反应 D.Ba(OH)2 • 8H2O晶体与NH4Cl晶体的反应
难度: 简单查看答案及解析
-
下列各组化合物中,化学键类型完全相同的时( )
A.CaCl2 和 Na2S B.Na2O 和Na2O2
C.CO2 和 CaO D.HCl 和NaOH
难度: 中等查看答案及解析
-
下表是某城市空气质量每周公报的部分内容。对表中3个空气质量指标不会产生影响的是( )
项目
空气污染指数(API)
空气质量级别
空气质量描述
总悬浮颗粒
52
Ⅱ
良
二氧化硫
7
I
优
二氧化氮
24
I
优
A.焚烧垃圾 B.使用含磷洗衣粉 C.汽车排放的尾气 D.用煤和石油产品
难度: 简单查看答案及解析
-
下列实验能达到预期目的的是( )
A.检验溶液中是否含有CO32-:滴加稀盐酸,将产生的气体通入澄清石灰水
B.检验溶液中是否含有SO42-:先滴加氯化钡溶液,再滴加稀盐酸
C.检验溶液中是否含有Fe2+:先滴加氯水,再滴加KSCN溶液
D.检验溶液中是否含有NH4+:先滴加浓NaOH溶液并加热,再用湿润的红色石蕊试纸
难度: 中等查看答案及解析
-
下列事实与浓硫酸表现出的性质(括号中)对应关系正确的是( )
A.浓硫酸使胆矾晶体变白(脱水性)
B.在加热条件下铜与浓硫酸反应(氧化性、酸性)
C.蔗糖与浓硫酸反应中有海棉状的炭生成(吸水性)
D.浓硫酸可用来干燥某些气体(不挥发性)
难度: 中等查看答案及解析
-
同周期的IIA族元素与IIIA族元素核电荷数相差不可能是( )
A.1 B.11 C.17 D. 25
难度: 中等查看答案及解析
-
重水(D2O)是重要的核工业原料,下列说法错误的( )
A.氘(D)原子核外有1个电子 B.1H与D互称同位素
C.H2O与D2O互称同素异形体 D.1H218O与D216O的相对分子质量相同
难度: 简单查看答案及解析
-
下列对元素性质递变规律描述正确的是( )
A.Li、Na、K元素的金属性依次减弱
B.P、S、Cl元素的最高正价依次降低
C.Li、Be、B的原子最外层电子数依次减少
D.Na+、Mg2+、Al3+的离子半径依次减少
难度: 中等查看答案及解析
-
下列有关化学用语表达不正确的是( )
A.氮气的电子式:∶N∶∶∶N∶ B.次氯酸分子的结构式:H-O-Cl
C.Na的原子结构示意图:
D.钙离子的电子式:Ca2+
难度: 中等查看答案及解析
-
对于放热反应H2+Cl2
2HCl,下列说法中,正确的是( )。
A.生成物所具有的总能量高于反应物所具有的总能量
B.反应物所具有的总能量高于生成物所具有的总能量
C.断开1molH-H键和1molCl-Cl键所吸收的总能量大于形成2molH-Cl键所放出的能量
D.该反应中,化学能只转变为热能
难度: 中等查看答案及解析
-
标准状况下,两个体积相等的干燥圆底烧瓶中分别充满①NH3;②NO2进行喷泉实验。经充分反应后,瓶内溶液的物质的量浓度是( )

A.①=②
B.①<②
C.①>②
D.不能确定
难度: 中等查看答案及解析
-
将充满N2和NO2混合气体的试管倒立于水槽中,一段时间后进入试管内的水溶液占试管容积的一半并保持不变,则原混合气体中N2和NO2的体积比为( )
A.1:1 B.1:2 C.1:3 D.3:1
难度: 中等查看答案及解析
-
如果发现了原子序数为116的元素,下列对它的叙述中正确的是( )
①位于第7周期 ②非金属元素 ③最外电子层有6个电子 ④没有放射性
⑤属于氧族元素 ⑥属于锕系元素
A.①③⑤ B.②④⑥ C.①③⑥ D.③④⑤
难度: 中等查看答案及解析
-
某元素原子的质量数为A,它的阳离子Rn+核外有x个电子,w克这种元素的原子核内中子数为( )
A.
B.
C.
D.
难度: 中等查看答案及解析
-
X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如下图所示。若Y原子的最外层电子数是次外层电子数的3倍,下列说法中正确的是
A.原子半径: W>Z>Y>X
B.最高价氧化物对应水化物的酸性:Z>W>X
C.气态氢化物的稳定性:Z>W
D.W的单质能与水反应,生成一种具有漂白性的物质
难度: 中等查看答案及解析
-
如图所示装置中, M棒变细,N棒变粗.由此判断下表中所列M、N、R物质,其中合理的是( )

难度: 中等查看答案及解析
-
日常所用锌-锰干电池的电极分别为锌筒和石墨棒,以糊状NH4Cl作电解质,电极反应为:Zn-2e-=Zn2+,2MnO2+2
+2e-=Mn2O3+2NH3+H2O。下列有关锌-锰干电池的叙述中,正确的是
A.干电池中锌筒为正极,石墨棒为负极
B.干电池长时间连续工作后,糊状物可能流出,腐蚀用电器
C.干电池工作时,电流方向是由锌筒经外电路流向石墨棒
D.干电池可实现化学能向电能和电能向化学能的相互转化
难度: 中等查看答案及解析
-
对于反应A2+3B2=2C来说,以下表示中,反应速率最快的是 ( )
A.v(B2)=0.8 mol/ (L·s) B.v(A2)=0.4 mol/ (L·s)
C.v(C)=0.6 mol/ (L·s) D.v(B2)=1.0 mol/ (L·s)
难度: 中等查看答案及解析
-
在2L的密闭容器中进行反应:3H2+N2
2NH3,经过一段时间后,NH3的物质的量增加0.8 mol,在这段时间内用N2表示的平均反应速率为0.01 mol/ (L·s)。则这段时间为
 A.10s B.20s C.30s D.40s
A.10s B.20s C.30s D.40s难度: 简单查看答案及解析
-
1.52g铜镁合金完全溶解于50mL密度为1.40g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4 的混合气体1120mL (标准状况),向反应后的溶液中加入1.0mol/LNaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀,下列说法不正确的是( )
A.该合金中铜与镁的物质的量之比是2 ︰1
B.该浓硝酸中HNO3的物质的量浓度是14.0mol/L
C.NO2和N2O4的混合气体中,NO2的体积分数是80%
D.得到2.54沉淀时,加入NaOH溶液的体积是600mL
难度: 简单查看答案及解析