-
某食品袋中有一个写着“干燥剂”的小纸袋,里面的主要成分是生石灰,对此“干燥剂”的
说法正确的是
A.小纸袋中的物质可长期持续地做干燥剂
B.生石灰属于盐类
C.此干燥剂为混合物
D.其中钙元素的存在形态为游离态
难度: 中等查看答案及解析
-
下列有关分散系说法错误的是
A.胶体区别于其它分散系的本质特征是胶体粒子的直径大小在10-9~10-7m之间
B.Fe(OH)3胶体能够使水中悬浮的固体颗粒沉降,达到净水目的
C.用平行光照射NaCl溶液和Fe(OH)3胶体时,产生的现象不相同
D.用肉眼观察,均匀透明的分散系一定是溶液
难度: 中等查看答案及解析
-
下列反应既是化合反应,又是氧化还原反应的是
A.NaOH + HCl == NaCl + H2O
B.2CO + O2点燃2CO2
C.H2 + CuO
Cu + H2O
D.CaO + H2O == Ca(OH)2
难度: 中等查看答案及解析
-
下列叙述正确的是
A.1mol任何气体的体积一定是22.4L
B.标准状况下,1mol N2和CO混合气体所占的体积约为22.4L
C.在标准状况下,体积为22.4L的物质都是1mol
D.在非标准状况下,1mol任何气体的体积不可能是22.4L
难度: 中等查看答案及解析
-
下列叙述正确的是
A.1molCO2的质量为44g·mol-1
B.SO42-的摩尔质量为96g
C.44g CO2的体积为22.4L
D.9.8g H2SO4含0.4NA个氧原子
难度: 中等查看答案及解析
-
下列溶液中Cl-浓度最大的是
A.200mL 2mol/L MgCl2溶液
B.1000mL 2.5mol/L NaCl溶液
C.300mL 5mol/L KClO3溶液
D.250mL 1mol/L AlCl3溶液
难度: 中等查看答案及解析
-
下列物质中属于电解质的是
A.熔融的氯化镁 B.金属铜 C.二氧化碳 D.酒精
难度: 简单查看答案及解析
-
日本核电站泄漏物中含有放射性的53131I。有关53131I的说法不正确是
A.中子数为78 B.质子数为53
C.质量数为131 D.核外电子数是78
难度: 中等查看答案及解析
-
下列各组微粒中,互为同位素的是
A.
H2 和
H2 B.
Cl 和
Cl
C.O3 和 O2 D.
N 和
C
难度: 中等查看答案及解析
-
下列反应,不属于氧化还原反应的是
A.Fe+CuSO4===FeSO4+Cu
B.2HClO
2HCl+ O2↑
C.2Na2O2+ 2CO2===2Na2CO3+ O2↑
D.CaCO3+H2O+CO2=== Ca(HCO3)2
难度: 中等查看答案及解析
-
下列实验操作正确的是
A.萃取时,可选用CCl4或酒精作为萃取剂从溴水中萃取溴
B.蒸发时,应使混合物中的水分完全蒸干后,才能停止加热
C.蒸馏时,冷却水应从冷凝管的下口通入,上口流出
D.分液时,分液漏斗中下层液体从下口放出,上层液体也从下口放出
难度: 中等查看答案及解析
-
在电解食盐水之前,需要提纯食盐水。为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列五项操作,正确的操作顺序是
①过滤 ②加过量的NaOH溶液 ③加适量的盐酸
④加过量的碳酸钠溶液 ⑤加过量的氯化钡溶液
A.①④②⑤③ B.④①②⑤③
C.②⑤④①③ D.⑤②④③①
难度: 中等查看答案及解析
-
将下列各组物质区别开来的实验方案(括号内为鉴别方法)错误的是
A.丝绸与棉布(采用灼烧,闻其气味的方法)
B.(NH4)2SO4与NH4Cl(加碱加热,并用湿润的红色石蕊试纸检验生成的气体)
C.NaCl与KCl(采用焰色反应,观察焰色的方法)
D.K2CO3与KNO3(采用加盐酸观察有无气泡产生的方法)
难度: 中等查看答案及解析
-
下列化学用语书写正确的是
A.中子数为10的氧原子:108O
B.纯碱的化学式:NaOH
C.碳酸钾的电离方程式:K2CO3 = 2K+1 + CO3-2
D.氯离子的结构示意图为:
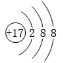
难度: 中等查看答案及解析
-
设NA代表阿伏加德罗常数,下列说法正确的是
A.含0.2NA个氮原子的氮气物质的量为0.1mol
B.标准状况下,18g水所具有的体积为22.4L
C.11.2L氦气所含的分子数目为0.5NA
D.1mol的NaCl溶解在1L的水中可以得到1mol/L的NaCl溶液
难度: 中等查看答案及解析
-
3NO2十H2O====2HNO3十NO为工业上氨催化氧化法制硝酸的反应之一,该反应中NO2的作用是
A.只作氧化剂 B.作催化剂
C.既作氧化剂又作还原剂 D.作还原剂
难度: 中等查看答案及解析
-
(3分)对于反应3Cl2 + 6NaOH ==5NaCl + NaClO3 + 3H2O,以下叙述正确的是
A.Cl2是氧化剂,NaOH是还原剂
B.每生成1mol的NaClO3转移6mol的电子
C.Cl2既是氧化剂又是还原剂
D.被氧化的Cl原子和被还原的Cl原子的物质的量的比为5∶1
难度: 中等查看答案及解析