-
X、Y为短周期元素,X位于IA族,X与Y可形成化合物X2Y,下列说法正确的是( )
A.X的原子半径一定大于Y的原子半径
B.X与Y的简单离子不可能具有相同的电子层结构
C.X2Y可能是离子化合物,也可能是共价化合物
D.两元素形成的化合物中,原子个数比不可能为1:1难度: 中等查看答案及解析
-
《科学》杂志评出2004年10大科技突破,其中“火星上‘找’到水的影子”名列第一.下列关于水的说法中正确的是( )
A.水的电离过程是放热的过程
B.盐的水解一定能促进水的电离
C.催化剂能提高水分解的转化率
D.金属的电化腐蚀与水无关难度: 中等查看答案及解析
-
在室温下,将pH=a的酸和pH=b的碱等体积混合,若a+b=14,且混合后溶液的pH小于7.则该酸和碱的组合可以是( )
A.醋酸和氢氧化钠
B.盐酸和氨水
C.硫酸和氢氧化钾
D.硝酸和氢氧化钡难度: 中等查看答案及解析
-
已知C3N4晶体具有比金刚石还大的硬度,且构成该晶体的微粒间只以单键结合.下列关于C3N4晶体的说法错误的是( )
A.该晶体属于原子晶体,其化学键比金刚石更牢固
B.该晶体中每个碳原子连接4个氮原子、每个氮原子连接3个碳原子
C.该晶体中碳原子和氮原子的最外层都满足8电子结构
D.该晶体与金刚石相似,都是原子间以非极性键形成空间网状结构难度: 中等查看答案及解析
-
下列比较中,正确的是( )
A.常温下,同浓度的一元酸HA比HB易电离,则相同浓度的NaA溶液比NaB溶液的pH大
B.0.2mol/L NH4NO3和0.lmol/LNaOH溶液等体积混合后:c(NH4+)>c(NO3-)>c(Na+)>c(OH-)>c(H+)
C.物质的量浓度相等的醋酸溶液和氢氧化钠溶液等体积混合:c(Na+)+c(H+)=c(CH3COO-)+c(OH-)+c(CH3COOH)
D.同浓度的下列溶液:①NH4Al(SO4)2②NH4Cl③NH3•H2O,其中c(NH4+)由大到小的顺序是:①>②>③难度: 中等查看答案及解析
-
在25℃,101kPa下,1mol的白磷(化学式为P4)完全燃烧放出的热量比4mol的红磷(化学式为P)完全燃烧放出的热量多.反应方程式分别为:P4 (s)+5O2 (g)=P4O10 (s) 4P (s)+5O2 (g)=P4O10 (s)
由此判断,下列说法正确的是( )
A.由红磷转化为白磷是吸热反应,等质量时红磷能量比白磷高
B.由红磷转化为白磷是放热反应,等质量时红磷能量比白磷低
C.由红磷转化为白磷是放热反应,等质量时红磷能量比白磷高
D.由红磷转化为白磷是吸热反应,等质量时红磷能量比白磷低难度: 中等查看答案及解析
-
下面有三则关于“CO2”的消息:
(1)1999年美国《科学》杂志报道:在40Gpa的高压下,用激光器加热到1800K,人们成功地制得了原子晶体干冰.
(2)CCTV《科技博览》报道,2004年3月中科院首创用CO2合成降解塑料聚二氧化碳.
(3)超临界流体是温度和压力同时高于临界值的流体,也即压缩到具有接近液体密度的气体,是物质介于气态和液态之间的一种新的状态.
针对以上消息,下列推断中正确的是
①原子晶体干冰有很高的熔点、沸点;②原子晶体干冰易汽化,可用作致冷剂;③原子晶体干冰的硬度大,可用作耐磨材料;④聚二氧化碳塑料是通过加聚反应得到的;⑤聚二氧化碳塑料与干冰互为同素异形体;⑥聚二氧化碳塑料都属于纯净物;⑦聚二氧化碳塑料的使用会产生白色污染;⑧超临界二氧化碳与CO2的物理性质不同,但化学性质相同;⑨超临界二氧化碳可能是一种原子晶体;⑩超临界二氧化碳代替氟利昂可减轻对臭氧层的破坏( )
A.②③④⑨⑩
B.②③④⑤⑥⑧⑩
C.①③④⑧⑩
D.③④⑦⑧⑨难度: 中等查看答案及解析
-
某溶液中可能含有Ba2+、I-、NH4+、Cu2+、SO32-,向该溶液中加入少量溴水,溶液仍呈无色,则下列关于该溶液组成的判断正确的是( )
①肯定不含I- ②肯定不含Cu2+ ③肯定含有SO32- ④可能含有I- ⑤可能含有Ba2+.
A.①⑤
B.①②③
C.③④
D.②③④难度: 中等查看答案及解析
-
根据下列实验现象,所得结论正确的是( )
实验 实验现象 结论 A 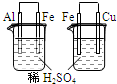
左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡活动性:Al>Cu>Fe B 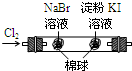
左边棉花变为橙色,右边棉花变为蓝色氧化性:Cl2>Br2>I2 C 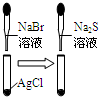
白色固体先变为淡黄色,后变为黑色溶解性AgCl>AgBr>Ag2S D 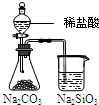
锥形瓶中有气体产生,烧杯中液体变浑浊非金属性:Cl>C>Si
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
下列说法正确的是( )
A.在NaHCO3溶液中一定有:c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-)
B.0.1mol•L-1的NaHS溶液中离子浓度关系:c(OH-)=c(H+)-c(S2-)+c(H2S)
C.NaOH与CH3COOH混合液中,可能出现:c(OH-)>c(Na+)>c(H+)>c(CH3COO-)
D.将标况下的2.24LCO2通入150mL1mol/LNaOH溶液中:c(HCO3-)<c(CO32-)难度: 中等查看答案及解析
-
如图在一定温度下,Ⅰ为恒压密闭容器,Ⅱ为恒容密闭容器.在Ⅰ、Ⅱ中分别加入2mol A和2mol B,起始时容器体积均为V L,发生如下反应并达到化学平衡状态:2A+B⇌xC(g),平衡时两容器中A、B、C的物质的量之比均为1:3:6.下列说法一定正确的是( )
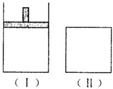
A.x的值为2
B.B物质可为固体或液体
C.Ⅰ、Ⅱ容器中从起始到平衡所需时间相同
D.平衡时,Ⅰ容器的体积小于VL难度: 中等查看答案及解析
-
“对氨基苯甲酸丁酯”是防晒霜中能吸收紫外线的防晒剂.下列关于“对氨基苯甲酸丁酯”的说法正确的是( )
A.它的分子式是C11H15NO2
B.从有机物分类看,它可属于“氨基酸类”、“酯类”、“芳香烃类”
C.它能与盐酸反应,但不能与苛性钠溶液反应
D.甲酸丁酯基(-COOC4H9)只有三种不同结构难度: 中等查看答案及解析
-
如图为实验室制氢气的简易装置.若在加稀硫酸时,发现锌粒与稀硫酸没有接触而稀硫酸又不够了,为使该反应顺利进行,则可以从长颈漏斗中加入的试剂是( )
①食盐水;②KNO3溶液;③适量稀硫酸铜溶液;④Na2CO3溶液;⑤CCl4;⑥浓氨水.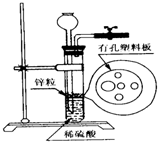
A.①③⑤
B.②⑥
C.③⑤
D.①②④难度: 中等查看答案及解析
-
某FeSO4、Fe2(SO4)3、H2SO4的混合溶液100mL,已知溶液中阳离子的物质的量浓度相同(不考虑水解),且SO42-的物质的量浓度为3mol/L,则此溶液最多可溶解铁粉的质量为( )
A.5.6g
B.8.4g
C.9.8g
D.11.2g难度: 中等查看答案及解析
-
下列离子方程式正确的是( )
A.用惰性电极电解饱和氯化镁溶液:2Cl-+2H2OH2↑+Cl2↑+2OH-
B.用银氨溶液检验乙醛中的醛基:CH3CHO+2Ag(NH3)2++2OH-CH3COONH4+3NH3+2Ag↓+H2O
C.苯酚钠溶液中通入少量CO2:CO2+H2O+2C6H5O-→2C6H5OH+2CO32-
D.Na2SO3溶液使酸性KMnO4溶液褪色:5SO32-+6H++2MnO4-=5SO42-+2Mn2++3H2O难度: 中等查看答案及解析
-
某无色溶液中可能含有 ①Na+、②Ba2+、③Cl-、④Br-、⑤SO42-、⑥SO32-离子中的若干种,依顺序进行下列实验,且每步所加试剂均过量,观察到的现象如下:
下列结论正确的是( )步骤 操作 现象 1 用pH试纸检验 溶液的pH大于7 2 向溶液中滴加氯水,再加入CCl4振荡,静置 CCl4层呈橙色 3 向所得水溶液中加入Ba(NO3)2溶液和稀HNO3 有白色沉淀产生 4 过滤,向滤液中加入AgNO3溶液 有白色沉淀产生
A.肯定含有的离子是①④⑥
B.不能确定的离子是①
C.肯定没有的离子是②⑤
D.不能确定的离子是③⑤难度: 中等查看答案及解析