-
①②③④ 四种金属片两两相连浸入稀硫酸中都可组成原电池,①②相连时,外电路电流从②流向①;①③相连时,③为正极;②④相连时,②有气泡逸出;③④相连时,③的质量减少,据此判断这四种金属活动性由大到小的顺序是
A. ①③②④ B. ①③④② C. ③④②① D. ③①②④
难度: 中等查看答案及解析
-
下列叙述正确的是( )
A. 同周期元素的原子半径以ⅦA族的为最大
B. 第3周期主族元素最高化合价等于它所处的主族序数
C. 短周期元素形成离子后,最外层都达到8电子稳定结构
D. 短周期中次外层电子数是最外层电子数2倍的原子一定是非金属元素
难度: 中等查看答案及解析
-
化学科学需要借助化学专用语言描述,下列有关化学用语正确的是
A.H2O的电子式:
B.质量数为14的碳原子:
C.CO2的比例模型:
 D.Cl-的结构示意图:
D.Cl-的结构示意图:
难度: 中等查看答案及解析
-
下列变化属于吸热反应的是( )
①碳与二氧化碳化合 ②生石灰与水反应生成熟石灰 ③Zn与稀硫酸反应
④氯酸钾分解制氧气 ⑤Ba(OH)2 • 8H2O与NH4Cl反应 ⑥甲烷与氧气的燃烧
A. ①④⑤ B. ②③ C. ①④ D. ①②④
难度: 中等查看答案及解析
-
下列各组物质,化学键类型相同、晶体类型相同且熔化时破坏作用力类型也相同的是
A. 金刚石 石墨 B. NH4Cl KCl C. H2S CCl4 D. CO2 SiO2
难度: 中等查看答案及解析
-
下列叙述正确的是
A. ⅠA族元素单质的熔点从上往下逐渐降低
B. 分子晶体中一定存在共价键
C. ⅥA族元素的氢化物中,稳定性最好的其沸点也最高
D. 同周期非金属氧化物对应的水化物的酸性从左往右依次增强
难度: 中等查看答案及解析
-
下列各对物质中属于同分异构体的是( )
A.
和
B. 白磷和红磷
C.
和
D.
 和
和
难度: 中等查看答案及解析
-
下列顺序排列不正确的是( )
A. 热稳定性:H2O>HF>H2S B. 原子半径:Na>Mg>O
C. 酸性:HClO4>H2SO4>H3PO4 D. 非金属性:F>Cl>Br
难度: 中等查看答案及解析
-
一种新型材料B4C3,它可用于制作切削工具和高温热交换器。关于B4C3的推断正确的是( )
A. B4C3是一种分子晶体 B. B4C3是一种离子晶体
C. B4C3是一种原子晶体 D. B4C3分子是由4个硼原子和3个碳原子构成的
难度: 中等查看答案及解析
-
下列依据热化学方程式得出的结论正确的是 ( ) ( )。
A.已知2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ·mol-1,则氢气的燃烧热为241.8 kJ·mol-1
B. 已知NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1,则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出57.3 kJ的热量
C.已知2C(s)+2O2(g)===2CO2(g) ΔH=a;2C(s)+O2(g)===2CO(g) ΔH=b,则a>b
D.已知C(石墨,s)===C(金刚石,s) ΔH>0,则石墨比金刚石稳定
难度: 中等查看答案及解析
-
如图是元素周期表的一部分,下列说法中正确的是

A. 元素①位于第2周期第ⅣA族
B. 气态氢化物的稳定性:④>②
C. 最高价氧化物对应水化物的酸性:⑤>④
D. 元素的最高正化合价:③=⑤
难度: 中等查看答案及解析
-
下列叙述不正确的是( )
A.铁表面镀锌,铁作阳极
B.船底镶嵌锌块,锌作负极,以防船体被腐蚀
C.钢铁吸氧腐蚀的阴极反应:O2+2H2O+4e-===4OH-
D.工业上电解饱和食盐水的阳极反应:2Cl--2e-===Cl2↑
难度: 中等查看答案及解析
-
下列能说明氯元素比硫元素非金属性强的是( )
①HCl比H2S稳定;②HClO4酸性比H2SO4强;③Cl2能与H2S反应生成S;④Cl原子最外层有7个电子,S原子最外层有6个电子;⑤Cl2比S更易与H2化合生成相应气态氢化物;⑥盐酸是强酸,而氢硫酸是弱酸。
A. ①②③④⑤⑥ B. ①②③④⑥ C. ①②③⑤ D. ②④⑥
难度: 困难查看答案及解析
-
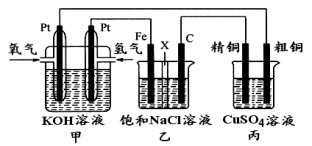
利用下图装置,能完成很多电化学实验。下列有关此装置的叙述中,错误
的是:( )

A、若X为锌棒,Y为NaCl溶液,开关K置于M处,可减缓铁的腐蚀,这种方法称为牺牲阳极的阴极保护法
B、若X为碳棒,Y为NaCl溶液,开关K置于N处,可减缓铁的腐蚀,这种方法称为外加电流的阴极保护法
C、若X为铜棒,Y为硫酸铜溶液,开关K置于M处时,铁电极上的电极反应式为Cu2++2e-===Cu
D、若X为铜棒,Y为硫酸铜溶液,开关K置于N处时,溶液中各离子浓度都不会发生变化
难度: 困难查看答案及解析
-
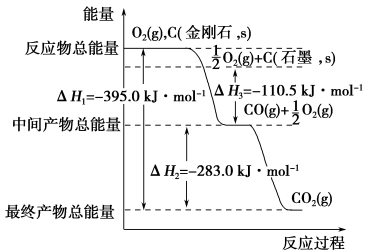
单斜硫和正交硫是硫的两种同素异形体。已知
①S(s,单斜)+O2(g)===SO2(g) ΔH1=-297.16 kJ/mol
②S(s,正交)+O2(g)===SO2(g) ΔH2=-296.83 kJ/mol ,下列说法正确的是( )
A. 正交硫比单斜硫稳定
B. S(s,单斜)===S(s,正交) ΔH3=+0.33 kJ/mol
C. 相同物质的量的正交硫比单斜硫所含有的能量高
D. ①式表示断裂1 mol O2中的共价键所吸收的能量比形成1 mol SO2中的共价键所放出的能量多297.16 kJ
难度: 困难查看答案及解析
-
X、Y、Z、W为周期表中前20号元素中的四种,原子序数依次增大,W、Y为金属元素,X原子的最外层电子数是次外层电子数的3倍,Y、Z位于同周期,Z单质是一种良好的半导体。W能与冷水剧烈反应,Y、Z原子的最外层电子数之和与X、W原子的最外层电子数之和相等。下列说法正确的是 ( )
A. 原子半径:W>Y>Z>X
B. 简单气态氢化物的稳定性:X<Z
C. 最高价氧化物对应水化物的碱性:Y>W
D. Y、Z的氧化物都具有两性
难度: 困难查看答案及解析
-
美国海军航空站安装了MCFC型燃料电池,该电池可同时供应电和水蒸气,其工作温度为600℃~700℃,所用燃料为H2,电解质为熔融的K2CO3,已知该电池的总反应为2H2+O2═2H2O,负极反应为H2+CO32﹣﹣2e﹣═H2O+CO2,则下列推断正确的是( )
A. 正极反应为:4OH﹣═O2+2H2O+4e﹣
B. 放电时CO32﹣ 向负极移动
C. 电池供应1mol水蒸气,转移的电子数为4mol
D. 放电时CO32﹣ 向正极移动
难度: 困难查看答案及解析
-
在一定条件下RO3—与R—发生如下反应:RO3—+5R—+6 H+=3R2+3H2O,则下列关于R元素的说法中正确的是:( )
A. R位于元素周期表中的第VA族 B. R的氢化物的水溶液呈酸性
C. RO3—中的R元素只能被还原 D. R2在常温常压下一定是气体
难度: 中等查看答案及解析
-
H2和I2在一定条件下能发生反应:H2(g)+I2(g)
2HI(g) ΔH=-a kJ·mol-1
已知:

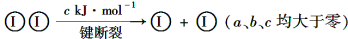 ,下列说法不正确的是( )
,下列说法不正确的是( )A. 反应物的总能量高于生成物的总能量
B. 断开2 mol H—I键所需能量约为(c+b+a)kJ
C. 断开1 mol H—H键和1 mol I—I键所需能量大于断开2 mol H—I键所需能量
D. 向密闭容器中加入2 mol H2和2 mol I2,充分反应后放出的热量小于2a kJ
难度: 困难查看答案及解析
-
铅蓄电池的工作原理为:Pb+PbO2+2H2SO4===2PbSO4+2H2O,研读下图,下列判断不正确的是

A.K闭合时,d电极反应式:PbSO4+2H2O-2e-===PbO2+4H++SO42-
B.当电路中转移0.2 mol电子时,Ⅰ中消耗的H2SO4为 0.2 mol
C.K闭合时,Ⅱ中SO42-向c电极迁移
D.K闭合一段时间后,Ⅱ可单独作为原电池,d电极为正极
难度: 中等查看答案及解析