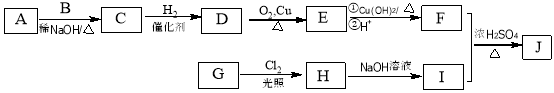
-
下列说法正确的是( )
A.为测定新制氯水的pH,用玻璃棒蘸取液体滴在pH试纸上,与标准比色卡对照即可
B.燃料的脱硫脱氮、SO2的回收利用和NOx的催化转化都是减少酸雨产生的措施
C.要将溶解在CCl4中的碘单质分离出来,可以用蒸馏法,因为碘易升华,先分离出来
D.提纯混有少量硝酸钾的氯化钠,应采用在较高温度下制得浓溶液再冷却结晶、过滤、干燥的方法
难度: 中等查看答案及解析
-
实验是化学研究的基础,下列关于各实验装置的叙述正确的是
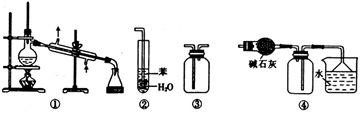
A.装置①常用于分离乙醇或苯等与水组成的混合物
B.装置②可用于吸收NH3或HCl气体,并防止倒吸
C.装置③可用于收集H2、CO2、Cl2、NO等气体
D.装置④可用于干燥、收集氨气,并吸收多余的氨气
难度: 简单查看答案及解析
-
以下数值大于或等于阿伏加德罗常数的是( )
A.含4.8g碳元素的石墨晶体中的共价键数
B.250 mL 1 mol•L-1FeCl3溶液中,阴、阳离子总数
C.一定条件下,将1mol SO2和0.5 mol O2充入一密闭容器内,充分反应后的生成物分子数
D.在反应KClO4+8HCl=KCl+4Cl2↑+4H2O中,每生成0.5 molCl2转移的电子数
难度: 简单查看答案及解析
-
下列表示对应化学反应的离子方程式正确的是( )
A.NaHSO4溶液与Ba(OH)2溶液反应至中性:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
B.5molFe和4molCl2反应:5Cl2+4Fe
2FeCl2+2FeCl3
C.向Ca(ClO)2 溶液中通入过量的 SO2:C1O-+SO2+H2O=HClO+HSO3-
D.FeSO4酸性溶液中加H2O2:2Fe2++H2O2=2Fe3++2OH-
难度: 中等查看答案及解析
-
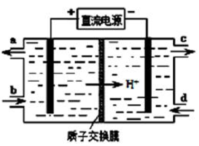
乙烯催化氧化成乙醛可设计成如图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:2CH2=CH2+O2→2CH3CHO.下列有关说法正确的是( )
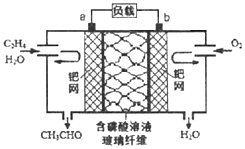
A.该电池为可充电电池
B.每有0.1mol O2反应,则迁移H+0.4mol
C.正极反应式为:CH2=CH2-2e-+2OH-═CH3CHO+H2O
D.电子移动方向:电极a→磷酸溶液→电极
难度: 中等查看答案及解析
-
美国梅奥诊所的研究人员发现,绿茶中含有EGCG能使中癌细胞自杀性死亡,已知EGCG的结构如右图所示,有关EGCG的说法中不正确的是
①EGCG能与碳酸钠溶液反应放出二氧化碳
②EGCG遇FeCl3溶液能发生显色反应
③1molEGCG最多可与含10mol氢氧化钠溶液完全作用
④EGCG在空气中易氧化
⑤1molEGCG最多可与含7mol溴单质的溴水发生反应
A.①②④ B.①③⑤ C.②④⑤ D.②③④
难度: 困难查看答案及解析
-
已知0.1mol/L的二元酸H2A溶液的PH=4,则下列说法中不正确的是( )
A.在Na2A和NaHA溶液中离子种类相同
B.在溶质物质的量浓度相等的Na2A和NaHA溶液中,阴离子总数相等
C.在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+2c(A2-)
D.在Na2A溶液中一定有:c(OH-)=c(H+)+c(HA-)+2c(H2A)
难度: 中等查看答案及解析
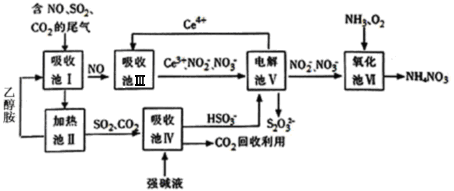
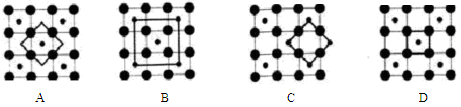
 ),在该晶体中与一个钴原子等距离且最近的钴原子有_________个;筑波材料科学国家实验室一个科研小组发现了在 5K 下呈现超导性的晶体,该晶体具有CoO2的层状结构(如下图所示,小球表示Co原子,大球表示O原子)。下列用粗线画出的重复结构单元示意图不能描述CoO2的化学组成的是_____________。
),在该晶体中与一个钴原子等距离且最近的钴原子有_________个;筑波材料科学国家实验室一个科研小组发现了在 5K 下呈现超导性的晶体,该晶体具有CoO2的层状结构(如下图所示,小球表示Co原子,大球表示O原子)。下列用粗线画出的重复结构单元示意图不能描述CoO2的化学组成的是_____________。