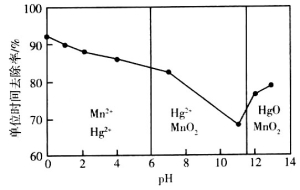
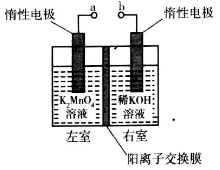
-
下表中对应关系正确的是

难度: 中等查看答案及解析
-
下列说法正确的是
A.18gH218O含有l0NA个质子
B.过量铁粉在氯气中燃烧生成FeCl2
C.0.1mol·L-1NaAlO2溶液中可以大量存在:HCO3-、NH4+、SO42-、Fe3+
D.在FeSO4溶液中加入CuS固体,溶液中c(Fe2+)不变,说明ksp(CuS)远小于Ksp(FeS)
难度: 中等查看答案及解析
-
对下图两种化合物的结构或性质描述正确的是
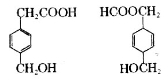
A.互为同分异构体
B.均能与Na反应且产物相同
C.均可发生取代反应和加成反应
D.分子中共平面的碳原子数相同
难度: 中等查看答案及解析
-
下列实验设计或操作正确的是
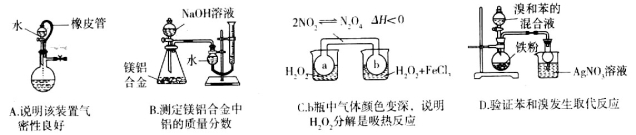
难度: 中等查看答案及解析
-
X、Y、Z、W、R均为第三周期主族元素,且原子序数依次增大。X、Y、W的最高价氧化物对应水化物两两之间都能发生反应,Z的单质具有半导体的特性,W原子的最外层电子数是其电子层数的2倍。下列说法错误的是
A.X与氧元素形成的化合物中可能含有共价键
B.第三周期元素的简单离子中Y离子的半径最小
C.Z、W的氧化物均为酸性氧化物
D.R元素含氧酸的酸性一定强于W
难度: 中等查看答案及解析
-
某混合溶液中含有NaI、NaBr、Na2SO3三种溶质,其物质的量均为l mol,向混合溶液中通入一定量的氯气。下列说法正确的是
A.将溶液蒸干最多可以得到4 mol NaCl
B.将溶液蒸干并灼烧,得到的固体可能是NaCl、NaBr、Na2SO4
C.向溶液中滴加KI淀粉溶液,溶液变蓝,则氯气一定过量
D.若通入氯气的体积为11.2 L(标准状况),反应的离子方程式为:2I-+Cl2=I2+2C1-
难度: 困难查看答案及解析
-
25℃时,H2SO3及其钠盐的溶液中,H2SO3、HSO3-、SO32-的物质的量分数(α)随溶液pH变化关系如下图所示,下列叙述错误的是
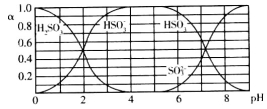
A.溶液的pH=5时,硫元素的主要存在形式为HSO3-
B.当溶液恰好呈中性时:c(Na+)>c(SO32-)+c(HSO3-)
C.向pH=8的上述溶液中滴加少量澄清石灰水,
的值增大
D.向pH=3的上述溶液中滴加少量稀硫酸,α(HSO3-)减小
难度: 极难查看答案及解析
-
选做(12分)【化学——有机化学基础】有机化合物F的合成路线如下:
已知:

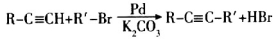
(1)A中含氧官能团的名称是____________。
(2)在B的同分异构体中,符合下列条件的同分异构体有________种;其中核磁共振氢谱有6组峰的是______(写结构简式)。
①属于芳香族化合物
②能发生水解反应
③能与溴水发生加成反应
(3)写出C与足量NaOH溶液在加热条件下反应的化学方程式:_____________________
(4)由D生成E的反应条件是____________________________。
(5)F的结构简式为______________________________________。
难度: 困难查看答案及解析