-
下列各组物质的分类正确的是( )
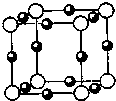
A.同位素:1H+、2H2、3H
B.同系物:丙烷、异丁烷、新戊烷
C.电解质:冰醋酸、水银、烧碱
D.酸性氧化物:一氧化氮﹑二氧化碳、三氧化硫难度: 中等查看答案及解析
-
下列对有关实验的描述不正确的是( )
A.在浓氨水中加入生石灰可以制取少量的NH3
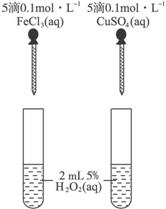
B.用水就可以一次性鉴别溴苯、苯、乙酸三种物质
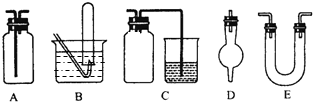
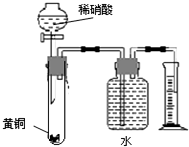
C.用如右图所示的装置可以测定黄铜(Cu、Zn合金)中Zn的含量
D.除去粗盐中的Ca2+、Mg2+、SO42-,依次加入的物质
可以是H2O、Ba(OH)2、Na2CO3、HCl难度: 中等查看答案及解析
-
分子式为C3H4Cl2链状有机物的同分异构体共有(不考虑顺反异构)( )
A.4种
B.5种
C.6种
D.7种难度: 中等查看答案及解析
-
下列各组中的反应,属于同一反应类型的是( )
A.乙烷和氯气制氯乙烷;乙烯与氯化氢反应制氯乙烷
B.乙醇和乙酸制乙酸乙酯;苯的硝化反应
C.葡萄糖与新制氢氧化铜共热;蔗糖与稀硫酸共热
D.乙醇和氧气制乙醛;苯和氢气制环己烷难度: 中等查看答案及解析
-
在常温时,将V1 mL C1 mol/L CH3COOH溶液中滴加到V2 mL C2 mol/L NaOH溶液中,下列结论中,错误的是( )
A.如果V1=V2,C1=C2,则混合溶液中c(CH3COO-)=c(Na+)
B.如果混合溶液的pH=7,则混合溶液中c(CH3COO-)=c(Na+)
C.如果混合溶液的pH>7,则可能V1C1=V2C2
D.如果V1=V2,且混合溶液的pH<7,则C1>C2难度: 中等查看答案及解析
-
a mol Cu与含b mol HNO3的溶液恰好完全反应,被还原的HNO3的物质的量一定是( )
A.(b-2a)mol
B.bmol
C.amol
D.2amol难度: 中等查看答案及解析
-
下列各组离子,在指定的环境中能够大量共存的是( )
选项 指定环境 能够共存的离子 A 滴加酚酞显红色的溶液 K+、S2-、SO32-、NO3- B 有HCO3-存在的无色透明溶液 Na+、K+、Cl-、Al3+ C 水电离的c(H+)=10-12 mol/L的溶液中 C1-、CO32-、NO3-、NH4+ D 使石蕊变红的溶液中 Fe2+、MnO4-、NO3-、SO42-
A.A
B.B
C.C
D.D难度: 中等查看答案及解析