-
当光束通过下列物质时,能观察到丁达尔效应的是
①有尘埃的空气 ②酒精 ③墨水 ④稀豆浆 ⑤硫酸铜溶液
A.①②④ B.①③⑤ C.①③④ D.②③④
难度: 中等查看答案及解析
-
下列有关焰色反应实验操作的说明不正确的是
A.没有铂丝可用无锈铁丝代替
B.先灼烧铂丝直到与酒精灯火焰颜色相同时,再蘸被检物质
C.再做不同金属的焰色反应时都要将铂丝蘸取氢氧化钠溶液洗涤并灼烧至没有颜色
D.焰色反应可以用于某些金属离子的鉴别
难度: 中等查看答案及解析
-
下列有关钠元素等的叙述中,错误的是
A.单质钠熔点低于100℃
B.钠元素只能以化合态存在于自然界
C.Na与Na+都具有强的还原性
D.金属钠具有好的导电性,但日常中不用作导线
难度: 中等查看答案及解析
-
实验室需用480mL0.10mol/L的硫酸铜溶液,以下操作正确的是
A.将12.00g胆矾配成500mL溶液
B.将12.50g胆矾溶于少量水中,再用水稀释至500mL
C.称取7.68g硫酸铜,加入500mL水
D.在80mL0.6mol/L CuSO4溶液中加入400mL水
难度: 中等查看答案及解析
-
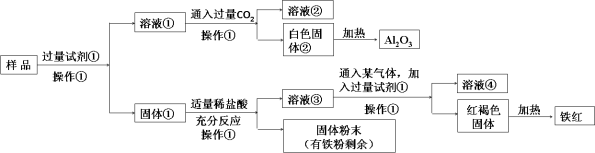
将Na2O2投入FeCl2溶液中, 完全反应后最终可观察到的现象是
A.生成白色沉淀 B.生成红褐色沉淀
C.生成灰绿色沉淀 D.没有气泡产生
难度: 中等查看答案及解析
-
下列说法正确的是
A.我国流通的硬币材质是金属单质
B.所有的不锈钢都只含有金属元素
C.黄铜的熔点高于金属铜,故应用广泛
D.镁合金的硬度和机械强度均高于纯镁
难度: 中等查看答案及解析
-
有关物质及其用途的描述,正确的是
①Al2O3(作耐火坩埚) ②KAl(SO4)2·12H2O(作水的消毒剂)③Fe2O3(作黄色油漆和涂料)
④NaHCO3(作食用碱) ⑤钠、钾、锶、钡等化合物(作烟花的焰色)⑥Na2O2(作呼吸面具供氧剂)
A.①④⑤⑥ B.①②⑤⑥ C.①③④⑤ D.全部
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列说法正确的是
A.1 molFeO与足量的盐酸反应,转移的电子数为2NA
B.均是1mol的 Na、Al、Fe分别与足量的盐酸反应,生成氢气的分子数分别是0.5NA、1.5NA、1NA
C.当5.6g的铁参与化学反应时,失去的电子数目一定为0.2NA
D.0.1NA铝与足量的盐酸反应比与足量的氢氧化钠溶液反应生成的H2分子数多
难度: 中等查看答案及解析
-
关于物质的量的叙述正确的是
A.常温常压下,4.4gCO2物质的量为0.1 mol
B.常温常压下,6.2g Na2O含有的Na+离子数为0.1mol
C.标准状况下,1 NA 个H2O分子含有氢分子数为1 mol
D.标准状况下,22.4L酒精的物质的量为1mol
难度: 中等查看答案及解析
-
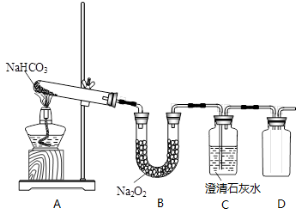
在下列实验过程中,出现的“异常”现象的解释,不正确的是
A.金属钠投入到硫酸铜溶液中,生成黑色沉淀物,是因为氢氧化铜的生成
B.过氧化钠加入到含有酚酞的水中,溶液变红再变无色,可能有强氧化性物质生成
C.过量的二氧化碳通入澄清石灰水中,溶液变浑浊再变澄清,说明最终生成可以溶于水的盐
D.在氯化亚铁的溶液中,滴加氢氧化钠溶液 ,先有白色沉淀,随后变灰绿色再变红褐色,说明氢氧化亚铁易被空气中的氧气氧化
难度: 中等查看答案及解析
-
下列除杂质的方法不可行的是
A.除去NaHCO3溶液中少量的Na2CO3:通入过量的CO2
B.除去FeCl2溶液中少量的FeCl3:加入稍过量铁粉,过滤
C.除去K2CO3固体中少量NaHCO3:置于坩埚中加热
D.用盐酸除去AgCl中少量的Ag2CO3
难度: 中等查看答案及解析
-
在2 L溶有0.2mol NaCl和0.2mol MgCl2的溶液中,Cl—的物质的量浓度为
A.0.05 mol/L B.0.1 mol/L C.0.2 mol/L D.0.3 mol/L
难度: 中等查看答案及解析
-
我们做了一系列关于Na2CO3和NaHCO3性质实验,根据你的实验观察和记录,下面关于Na2CO3和NaHCO3性质的结论,正确的是
A.受热时Na2CO3比NaHCO3稳定
B.同温同压下,在水中Na2CO3比NaHCO3溶解性小
C.Na2CO3和NaHCO3都既能与酸反应,又能与氢氧化钠反应
D.等质量的Na2CO3和NaHCO3分别与足量盐酸反应,Na2CO3放出的CO2多
难度: 中等查看答案及解析
-
用铝箔包着2.3g金属钠,放入50ml水中,放出的H2体积(标准状况)是
A.等于2.24L B.等于1.12L C.大于1.12L D.小于1.12L
难度: 中等查看答案及解析
-
在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如图所示,由此确定,原溶液中含有的阳离子是
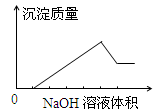
A.Mg2+、Al3+、Fe2+ B.H+、Mg2+、Al3+
C.H+、Ba2+、Al3+ D.只有Mg2+、Al3+
难度: 中等查看答案及解析
-
以下关于混合物分离提纯操作或原理说法正确的是
A.实验室中用含有Ca2+、Mg2+、Cl-的自来水制取蒸馏水,可采用蒸馏的方法
B.用CCl4萃取碘水的实验中,振荡静置后,下层为紫红色溶液
C.利用植物油的密度比水小的原理,可用分液的方法分离这两种液体混合物
D.蒸馏时,温度计的水银球应充分接触溶液
难度: 中等查看答案及解析
-
下列关于物质的类别的说法不正确的是
A.能在水溶液或熔融状态下导电的物质就是电解质
B.胶体是一种能产生丁达尔效应的分散系
C.纯碱不属于碱,干冰属于酸性氧化物
D.Na2O和Na2O2都能与水反应生成对应的碱,它们都是碱性氧化物
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A.AlCl3溶液中加入过量氨水 Al3++4NH3·H2O= AlO2ˉ + 4NH4+ + 2H2O
B.Ba(OH)2溶液中加入稀硫酸 Ba2+ + OHˉ + H+ + SO42-= BaSO4↓+ H2O
C.Cu(OH) 2浊液中滴加盐酸 Cu(OH) 2+2H+ = Cu2++2H2O
D.NaHCO3溶液与硫酸溶液的反应 HCO3-+H+ = H2O + CO2↑
难度: 中等查看答案及解析
-
下列离子能大量共存于同一溶液中的是
A.HCO3-、OHˉ、K+、Clˉ B.Al3+ 、H+ 、Clˉ、K+
C.SO42-、Na+、OHˉ、K+ D.Fe2+、K+、OHˉ、Clˉ
难度: 中等查看答案及解析
-
下列各组物质的稀溶液相互反应,无论是前者滴入后者,还是后者滴入前者,反应现象都相同的是
A.NaHSO4 和 Ba(OH)2 B.MgCl2和 NH3·H2O
C.Na2CO3和 HCl D.AlCl3 和 NaOH
难度: 中等查看答案及解析