-
可用于判断碳酸氢钠固体粉末中混有碳酸钠的实验方法是
A.加热时无气体放出
B.滴加盐酸时有气泡放出
C.溶于水后滴加稀BaCl2溶液有白色沉淀生成
D.溶于水后滴加澄清石灰水有白色沉淀生成
难度: 中等查看答案及解析
-
已知下列各物质的学名依次是:Na2S2O3叫硫代硫酸钠;CaSx叫多硫化钙;Na2O2叫过氧化钠;KO2叫超氧化钾。请你综合上述命名规律,比较、分析并确定:Na2CS3应读做
A.硫代碳酸钠 B.多硫碳酸钠 C.过硫碳酸钠 D.超硫碳酸钠
难度: 中等查看答案及解析
-
有关性质或反应的离子方程式表示不正确的是
A.FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+===4Fe3++2H2O
B.过量石灰水与碳酸氢钙反应:Ca2++2HCO
+2OH-===CaCO3↓+CO
+2H2O
C.向Na[Al(OH)4]溶液中通入过量CO2:[Al(OH)4]-+CO2===Al(OH)3↓+HCO
D.在强碱性溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:
4OH-+3ClO-+2Fe(OH)3===2FeO
+3Cl-+5H2O
难度: 困难查看答案及解析
-
某溶液中存在XO-,且X为短周期元素,则一定能在该溶液中大量共存的离子组是
A.Na+、H+、SO
、I- B.Na+、Ca2+、CO
、Al3+
C.Na+、K+、Fe2+、H+ D.K+、SO
、Cl-、CO
难度: 中等查看答案及解析
-
下表中叙述Ⅰ和叙述Ⅱ均正确并且互为因果关系的是
选项
叙述Ⅰ
叙述Ⅱ
A
NH4Cl是强酸弱碱盐
将NH4Cl溶液蒸干可制备NH4Cl固体
B
Fe3+有强氧化性
用KSCN溶液可以鉴别Fe3+
C
SO2有还原性
用SO2可使溴水褪色
D
Cl2有漂白性
用Cl2可与石灰乳反应制备含氯消毒剂
难度: 中等查看答案及解析
-
有关物质的性质和该性质的应用均正确的是
A.晶体硅具有半导体性质,可用于生产光导纤维
B.H2O2是一种绿色氧化剂,可与酸性高锰酸钾作用产生O2
C.铜的金属活动性比铁弱,可用铜罐代替铁罐贮存和运输浓硫酸或浓硝酸
D.铝具有良好的导电性,钢抗拉强度大,钢芯铝绞线可用作远距离高压输电线材料
难度: 中等查看答案及解析
-
已知A、B、C、D之间的转化关系为:A + B → C + D,则下列有关说法不正确的是
A.若A为Fe,D为氢气,则B可能是酸,也可能是水
B.若A、D为化合物,B为水,则C可能是气体单质,也可能是化合物
C.若A、B、C、D均为化合物,该反应一定属于复分解反应
D.若A、B、C、D均为10电子微粒,且C是可使湿润的红色石蕊试纸变蓝的气体,则D 在常温下一定呈液态
难度: 中等查看答案及解析
-
以下说法在一定条件下均可以实现的是
①酸性氧化物与碱发生反应;②弱酸与盐溶液反应可以生成强酸;③没有水生成,也没有沉淀和气体生成的复分解反应;④两种酸溶液充分反应后的溶液体系为中性;⑤有单质参加的非氧化还原反应;⑥两种氧化物反应的产物有气体
A.①②③④⑤⑥ B.②④⑤⑥ C.①②③⑤ D.③④⑤⑥
难度: 中等查看答案及解析
-
关于胶体的认识以及应用不正确的是
A.鸡蛋清溶液中加入饱和(NH4)2SO4溶液生成白色沉淀,属于物理变化
B.纳米材料微粒直径一般从几纳米到几十纳米(1 nm= 109 m).因此纳米材料属于胶体
C.往Fe(OH)3胶体中逐滴加入稀硫酸会产生沉淀而后沉淀逐渐溶解
D.水泥厂、冶金厂常用高压电除去烟尘,是因为烟尘微粒带电荷
难度: 简单查看答案及解析
-
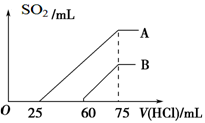
向某NaOH溶液中通入CO2气体后得溶液M,因CO2通入量的不同,溶液M的组成也相应不同。若向M中逐滴加入盐酸,产生气体的体积V(CO2)与加入盐酸的体积V(HCl)的关系分别有下列图示的四种情况,且(2)、(3)、(4)图中分别为:OA<AB,OA=AB,OA>AB。则下列分析与判断正确的是(注:为方便计算与判断,不计CO2的溶解)

A.M中只有一种溶质的只有(1)
B.M中有两种溶质的有(2)和(4)
C.(2)图显示M中c(NaHCO3) >c(Na2CO3)
D.(4)图显示M中c(NaHCO3) >c(Na2CO3)
难度: 中等查看答案及解析
-
饱和氯水与石灰石反应是制取较浓HClO溶液的方法之一。某兴趣小组进行了如下实验探究①在试管中加入过量的块状碳酸钙,再加入约20 mL饱和氯水(如下图所示),充分反应,有少量气泡产生,溶液浅黄绿色褪去;②过滤,将滤液滴在有色布条上,发现滤液比氯水的漂白性更强;③为了确定反应产物,将滤液分为三份,分别进行以下实验:第一份与石灰水混合,立即产生大量白色沉淀;第二份与稀盐酸混合,立即产生大量无色气体;第三份滤液加热,看到滤液变浑浊且有大量无色气体产生。经检测,上述实验中产生的无色气体均为CO2 。依据上述实验可推知:滤液中的溶质除CaCl2、HClO外,还有
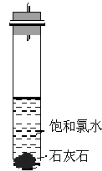
A.Ca (ClO)2 B.CaCO3 C.Ca(HCO3)2 D.CaO
难度: 中等查看答案及解析
-
某溶液中可能含有下列离子:Na+、Mg2+、NH4+、Cl―、SO32―、SO42―、NO3―和NO2―等,现将该溶液分成4份,分别进行如下实验:①酸化后滴加适量的淀粉KI溶液,呈蓝色;②滴加用盐酸酸化的BaCl2溶液,有白色沉淀析出;③滴加NaOH溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝;④加入足量硝酸酸化的AgNO3溶液,有沉淀产生,静置,在上层清液中滴加酸性KMnO4溶液,不褪色。则下列说法不正确的是
A.该溶液中一定含有NO3―、SO42―、NH4+
B.根据实验④可推出溶液中不存在NO2―与SO32―
C.往一定量该溶液中加入足量Ba(NO3)2溶液,静置后往上层清液中滴加硝酸酸化的AgNO3溶液,若有白色沉淀生成,说明溶液中含有Cl―
D.根据实验①可推出溶液中含有NO3―或NO2―
难度: 中等查看答案及解析
-
某课外活动小组的同学欲测定过氧化钠与碳酸钠混合物中过氧化钠的质量分数,他们先准确称量了a克样品,请你判断,在以下设计的各步后续实验方案中,不合理的是
A.隔绝空气加热,冷却后,称量剩余固体质量为m 1 g
B.与足量稀盐酸反应并蒸干,称量剩余固体质量为m 2 g
C.与足量水反应并加热,收集到标准状况下V1 L干燥气体
D.与足量稀硫酸反应并加热,收集到标准状况下V2 L 干燥气体
难度: 中等查看答案及解析
-
已知NH4CuSO3与足量的10 mol/L硫酸混合微热,产生下列现象:①有红色金属生成
②产生刺激性气味的气体 ③溶液呈现蓝色。请你据此判断下列说法正确的是
A.反应中硫酸作氧化剂
B.NH4CuSO3中硫元素被氧化
C.刺激性气味的气体是氨气
D.1 mol NH4CuSO3完全反应转移0.5 mol电子
难度: 中等查看答案及解析
-
设阿伏加德罗常数为NA,请你判断下列叙述中正确的是
A.2NA个HF分子所占的体积约为44.8L
B.46 g四氧化二氮和二氧化氮的混合气体中含有的原子数少于3NA
C.常温常压下,8.8 gCO2和N2O混合气体中所含的电子数为4.4NA
D.5.6 g铁与500 mL 2 mol · L-1硝酸反应,转移的电子数为0.2NA
难度: 中等查看答案及解析
-
某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,若向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量之间的关系如图所示。

则稀溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为
A.1∶1∶1 B.1∶3∶1 C.3∶3∶8 D.1∶1∶4
难度: 中等查看答案及解析