-
锗(Ge)是第四周期第ⅣA族元素,处于元素周期表中金属区与非金属区的交界线上,下列叙述正确的是
A. 锗是一种金属性很强的元素 B. 锗的单质具有半导体的性能
C. 锗化氢(GeH4)稳定性很强 D. 锗酸(H4GeO4)是难溶于水的强酸
难度: 中等查看答案及解析
-
“纳米材料”是指直径在几纳米到几十纳米的材料。如将“纳米材料”分散到液体分散剂中,所得混合物具有的性质是
A.能全部透过半透膜 B.有丁达尔效应
C.所得溶液一定能导电 D.所得物质一定为悬浊液或乳浊液
难度: 简单查看答案及解析
-
实验中的下列操作正确的是
A. 用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中
B. Ba(NO3)2溶于水,可将含有Ba(NO3)2的废液倒入水槽中,再用水冲入下水道
C. 用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液全部加热蒸干
D. 用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中
难度: 简单查看答案及解析
-
下列污染现象主要与NO2有关的是
A.光化学烟雾 B.水体富营养化 C.臭氧空洞 D.酸雨
难度: 简单查看答案及解析
-
298K下,将1mol蔗糖溶解在1L水中,此溶解过程中体系的∆G = ∆H-T∆S和∆S的变化情况是
A. ∆G>0,∆S<0 B. ∆G<0,∆S>0 C. ∆G>0,∆S>0 D. ∆G<0,∆S<0
难度: 简单查看答案及解析
-
下列与化学反应能量变化相关的叙述正确的是
A.反应热就是反应放出的热量
B.放热反应的反应速率总是大于吸热反应的反应速率
C.应用盖斯定律,可计算某些难以直接测量的反应热
D.同温同压下,H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件下的ΔH不同
难度: 简单查看答案及解析
-
对于可逆反应:2SO2(g)+O2(g)
2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是
A.增大压强 B.升高温度 C.使用催化剂 D.多充入O2
难度: 简单查看答案及解析
-
已知反应①2BrO3-+Cl2=Br2+2ClO3-
②5Cl2+I2+6H2O=2HIO3+10HCl
③ClO3-+5Cl-+6H+=3Cl2+3H2O,下列物质氧化能力强弱顺序正确的是
A.ClO3->BrO3->IO3->Cl2 B.BrO3- >Cl2>C1O3->IO3-
C.BrO3->ClO3->Cl2>IO3- D.Cl2>BrO3->C1O3->IO3-
难度: 中等查看答案及解析
-
下列各组物质都能使品红溶液褪色,且褪色原理相同的是
A、HClO,Na2O2 B、CO2,SO2 C、活性炭,SO2 D、活性炭,Na2O2
难度: 简单查看答案及解析
-
常温下已知两种一元弱酸HX和HY,如果向NaX溶液中通入少量CO2气体生成HX和NaHCO3;往NaY溶液中通入少量CO2生成HY和Na2CO3。下列有关叙述正确是
A.酸性由强至弱:HX>HY>H2CO3
B.结合H+的能力:Y->CO32->X->HCO3-
C.溶液碱性:NaX>Na2CO3>NaY>NaHCO3
D.NaX溶液中通入足量CO2后的离子浓度:c(Na+)>c(HCO3-)>c(X-)>c(OH-)>c(H+)
难度: 中等查看答案及解析
-
容量瓶上需标有:①温度;②浓度;③容量;④压强;⑤刻度线;⑥酸式或碱式;六项中的
A. ①③⑤ B. ③⑤⑥ C. ①②④ D. ②④⑥
难度: 简单查看答案及解析
-
下列各组在溶液中的反应,不管反应物量的多少,都只能用同一个离子方程式来表示的是
A、FeBr2与Cl2 B、Ba(OH)2与H2SO4
C、HCl与Na2CO3 D 、Ca(HCO3)2与NaOH
难度: 简单查看答案及解析
-
下列各选项中所述的两个量,前者一定大于后者的是
A.0.10mol·L-1的醋酸溶液和0.01mo·L-1的醋酸溶液中水的电离度
B.将pH=4的盐酸和醋酸分别稀释成pH=5的溶液,所加水的量
C.物质的量浓度相等的(NH4)2SO4溶液和(NH4)2SO3溶液中NH4+的浓度
D.物质的量浓度相等的CH3COONa溶液和 Na2CO3溶液的pH
难度: 中等查看答案及解析
-
在容积不变的密闭容器中,在一定条件下发生反应2A(?)
B(g)+C(s),达到化学平衡后,其他条件不变,升高温度时,容器内气体的密度增大,则下列叙述正确的是
A.若正反应是吸热反应,则A为气态
B.若正反应是放热反应,则A为气态
C.改变压强对平衡的移动无影响
D.在平衡体系中加入少量C,则平衡向逆反应方向移动
难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数,下列说法正确的是
A.常温常压下,23gNO2与N2O4的混合物中含有NA个氧原子
B.一定条件下,1.4g N2和0.2mol H2混合充分反应,转移的电子数为0.3NA
C.标准状况下,40g三氧化硫体积约为11.2L
D.1L1mol·L1的Na2CO3 溶液中阴离子数目小于NA
难度: 中等查看答案及解析
-
已知25℃、101kPa条件下:
4Al(s)+3O2(g)=2Al2O3;△H=-2834.9kJ·mol-1
4Al(s)+2O3(g)=2Al2O3;△H=-3119.1kJ·mol-1
由此得出的正确结论是
A.等质量的O2比O3能量低,由O2变O3为吸热反应
B.等质量的O2比O3能量低,由O2变O3为放热反应
C.O3比O2稳定,由O2变O3为吸热反应
D.O2比O3稳定,由O2变O3为放热反应
难度: 简单查看答案及解析
-
用1.0mol·L-1 NaOH溶液中和某浓度硫酸溶液时,其pH和所加NaOH溶液的体积关系如图所示。原硫酸溶液的物质的量浓度和完全反应后溶液的总体积是
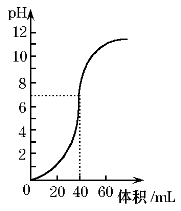
A.1mol·L-1,60mL B.0.5mol·L-1,80mL
C.0.5mol·L-1,40mL D.1mol·L-1.80mL
难度: 中等查看答案及解析
-
下列各组物质混合后,再加热蒸干并在300℃时充分灼烧至质量不变,最终一定能得到纯净物的是
A.向FeSO4溶液中通入过量Cl2
B.向NaHCO3溶液中加入一定质量的Na2O2粉末
C.向NaI和NaBr混合溶液中通入过量Cl2
D.向NaOH溶液中加入过量AlCl3
难度: 中等查看答案及解析
-
如下图所示的装置,C、D、E、F、X、Y都是惰性电极。将电池接通后,向乙中滴入酚酞溶液,在F极附近溶液显红色。则以下说法正确的是

A.电源B极是正极
B.甲、乙装置的C、D、E、F电极均有单质生成,其物质的量之比为1∶2∶2∶1
C.欲用丙装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液
D.装置丁中Y极附近红褐色变深,说明氢氧化铁胶粒带正电荷
难度: 困难查看答案及解析
-
我国某大城市今年夏季多次降下酸雨。据环保部门测定,该城市整个夏季酸雨的pH平均值为3.2。在这种环境中的铁制品极易被腐蚀。对此条件下铁的腐蚀的叙述不正确的是
A.此腐蚀过程有化学腐蚀也有电化学腐蚀
B.发生电化学腐蚀时的正极反应为2H2O+O2+4e-=4OH-
C.在化学腐蚀过程中有氢气产生
D.发生电化学腐蚀时的负极反应为Fe-2e-=Fe2+
难度: 中等查看答案及解析
-
有五个系列同族元素的物质,101.3kPa时测定它们的沸点(℃)如下表所示:
①
He -268.8
(a) -249.5
Ar -185.8
Kr 151.7
②
F2 -187.0
Cl2 -33.6
(b) 58.7
I2 184.0
③
(c) 19.4
HCl -84.0
HBr -67.0
HI -35.3
④
H2O 100.0
H2S -60.0
(d) -42.0
H2Te -1.8
⑤
CH4 -161.0
SiH4 -112.0
GeH4 -90.0
(e) -52.0
对应表中内容,下列叙述中正确的是
A.a、b、c代表的化学物中均含化学键
B.系列②物质均有氧化性;系列③物质对应水溶液均是强酸
C.系列④中各化合物的稳定性顺序为:H2O>H2S>H2Se>H2Te
D.上表中物质HF和H2O,由于化学键的影响,其沸点出现反常现象
难度: 中等查看答案及解析
-
几种短周期元素的原子半径及主要化合价如下表:
元素代号
X
Y
Z
W
原子半径/pm
160
143
70
66
主要化合价
+2
+3
+5、+3、-3
-2
下列叙述正确的是
A.X、Y元素的金属性Y>X
B.一定条件下,Z单质与W的常见单质直接生成ZW2
C.Y的最高价氧化物对应的水化物能溶于稀氨水
D.四种元素形成的单核离子半径由大到小的顺序为:Z3->W2->X2+>Y3+
难度: 中等查看答案及解析