-
2014年3月我国大部分地区被雾霾笼罩,PM2.5是指大气中直径小于或等于2.5微米(2.5×l0
m)的细小颗粒物,也称为可人肺颗粒物,下列有关说法中错误的是
A.大雾的形成与汽车的尾气排放有一定的关系
B.微粒直径为2.5微米的细小颗粒物与空气形成的分散系属于胶体
C.实施绿化工程,可以有效地防治PM2:5污染
D.PM2.5表面积大,能吸附大量的有毒、有害物质,吸人体内影响健康
难度: 中等查看答案及解析
-
设为阿伏加德罗常数的值。下列说法正确的是
A.常温常压下,15g甲基(-CH3)所含的中子数为6
B.一定条件下足量的Fe粉与浓硫酸反应,转移电子数一定为3
C.在1L的碳酸钠溶液中,若c(CO32-)=1mol/L,则Na+个数为2
D.含4
个离子的固体Na2O2溶于水配成1L溶液,所得溶液中Na+的浓度为1mol/L
难度: 中等查看答案及解析
-
下列离子方程式表达正确的是
A.向氯化铁溶液中滴加HI溶液:2Fe3++2HI=2Fe2++2H++I2
B.向NH4Al(SO4)2溶液中滴入Ba(0H)2恰好使反应完全:2Ba2++4OH-+Al3++2SO42-=2BaSO4↓+AlO2-+2H2O
C.1mol/L的NaAlO2溶液和2.5 mol/L的HCl等体积均匀混合:2AlO2-+5H+=Al(OH)3↓+Al3++H2O
D.用过氧化氢从酸化的海带灰浸出液中提取碘:2I-+H2O2=I2+2OH-
难度: 中等查看答案及解析
-
化学实验设计和操作中必须十分重视安全问题和环境保护问题,下列实验的设计或操作不合理的是
①实验室用加热分解KClO3的方法制取O2,排水收集O2后,先停止加热,再拆除实验装置。
②实验结束后,应将固体残渣深埋人土壤中,废液倒入下水道排除
③给试管中的液体加热时应不时移动试管,以免暴沸伤人
④为检验CO气体的纯度,用排空气法收集一试管气体,然后移近酒精灯火焰点燃,
听有无尖锐爆鸣声
A.①② B.①②③④ C.①②④ D.②④
难度: 中等查看答案及解析
-
下图是某有机物分子的比例模型,有关该物质的推断不正确的是
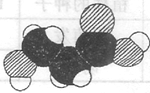
A.分子中可能含有羟基
B.分子中可能含有羧基
C.该物质的分子式可能为C3H6O3
D.分子中可能含有氨基
难度: 中等查看答案及解析
-
分子式为C7H8的某有机物,它能使酸性高锰酸钾溶液褪色,但不能与溴水反应。在一定条件下与H2完全加成,加成后其一氯代物的同分异构体有
A.3种 B.4种 C.5种 D.6种
难度: 中等查看答案及解析
-
常温下,体积、物质的量浓度均相等的四种溶液:
①盐酸;②醋酸;③氨水;④CH3COONa溶液。下列说法正确的是
A.将①与②分别稀释相同倍数后溶液的pH:①>②
B.若②与③混合后溶液呈中性,则在常温下Ka(CH3COOH)=Kb(NH3·H2O)
C.③与④中已电离的水分子的数目相等
D.②与④混合所得溶液显酸性,则:c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H+)
难度: 中等查看答案及解析
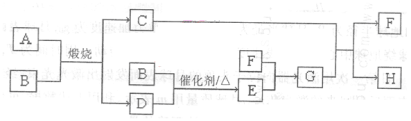
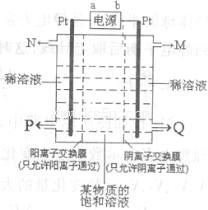
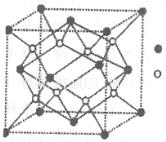
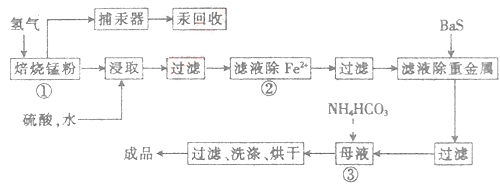
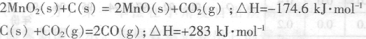
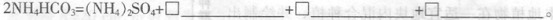
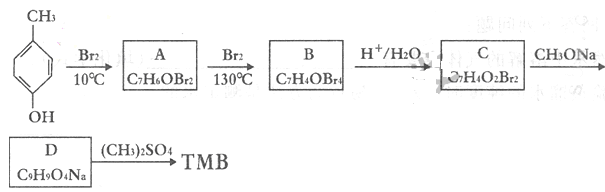
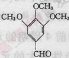 。请回答下列问题:
。请回答下列问题: