-
下列试剂的存放方法正确的是:
A. 浓硝酸存放在棕色广口试剂瓶中 B. 盛溴的试剂瓶里加少量水以减少溴的挥发
C. 少量白磷存放在煤油或CC14中 D. 碘单质可以保存在无色广口瓶中
难度: 中等查看答案及解析
-
下列仪器中,可用于直接加热的是:
①量筒 ②容量瓶 ③蒸馏烧瓶 ④试管 ⑤蒸发皿 ⑥烧杯 ⑦坩埚 ⑧锥形瓶
A. ③④⑥ B. ④⑤⑧ C. ②④⑤ D. ④⑤⑦
难度: 中等查看答案及解析
-
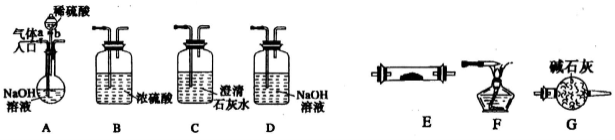
下列气体中,可用如图所示装置干燥、收集及处理尾气的气体是:
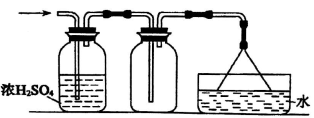
①H2 ②HCl ③NH3 ④Cl2 ⑤SO2 ⑥H2S ⑦NO
A. ①② B. ③④ C. ②⑤ D. ⑥⑦
难度: 困难查看答案及解析
-
现有几组实验:①除去食盐溶液中的砂石;②回收碘的CC14溶液中的CC14;③用食用酒精浸泡中草药提取其中的有效成分;④除去混在植物油中的水。分离以上各混合液的正确方法依次是:
A. 过滤、蒸馏、萃取、分液 B. 萃取、蒸馏、分液、过滤
C. 分液、萃取、蒸馏、升华 D. 蒸馏、萃取、分液、渗析
难度: 中等查看答案及解析
-
为达到预期的实验目的,下列操作正确的是:
A. 配制10%的CuSO4溶液:将10g CuSO4·5H2O溶解在90 g水中
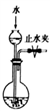
B. 检查右图所示装置气密性:
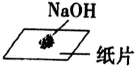
C. 称量一定质量的NaOH固体:
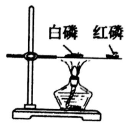
D. 比较红磷、白磷的着火点:
难度: 中等查看答案及解析
-
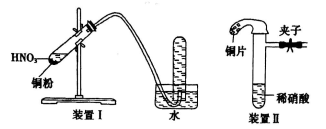
用下图装置测定水中氢、氧元素的质量比,其方法是分别测定通氢气前后玻璃管的质量差和U形管的质量差,实验测得m(H):m(O)>1:8。下列对导致这一结果的原因的分析中,一定错误的是( )

A. Ⅰ、Ⅱ装置之间缺少干燥装置
B. Ⅲ装置后缺少干燥装置
C. Ⅱ装置中玻璃管内有水冷凝
D. CuO没有全部被还原
难度: 中等查看答案及解析
-
下列变化能体现物质的漂白性的是:
A. SO2使酸性KMnO4溶液褪色 B. 乙烯使澳水褪色
C. Na2O2使无色酚酞先变红,后褪色 D. SO2使NaOH酚酞溶液褪色
难度: 中等查看答案及解析
-
下列有关实验安全的说法不正确的是:
A. 不慎将试验台上的酒精灯碰翻着火时,立即用湿抹布盖灭
B. 不慎将浓硫酸沾到皮肤上,应迅速用水冲洗,再涂上稀NaHCO3溶液
C. 如果将苯酚溶液沾到皮肤上,应立即用酒精或NaOH溶液擦洗
D. 若不慎将水银温度计打碎时,应立即撒上一层硫粉
难度: 中等查看答案及解析
-
某无色溶液中可能含有①Na+ 、②Ba2 +、③Cl一、④Br一、⑤SO32一、⑥SO42一 离子中的若干种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下。

下列结论正确的是( )
A. 肯定含有的离子是①④⑤ B. 肯定没有的离子是②⑥
C. 不能确定的离子是① D. 不能确定的离子是③⑤
难度: 困难查看答案及解析
-
下列实验方案合理的是:
A. 除去NaHCO3溶液中混有的Na2CO3:通入过量的二氧化碳气体
B. 清洗长期存放FeCl3溶液的试剂瓶内壁所附着的不溶物;用稀硫酸清洗
C. 分离I2和NH4Cl的固体混合物:加热混合物
D. 为了更快得到氢气:用纯锌代替粗锌与稀硫酸反应
难度: 中等查看答案及解析
-
下图为实验室制氢气的简易装置。若加一定量的稀硫酸后,发现锌粒与稀硫酸无法接触,为使该反应顺利进行,则可以从长颈漏斗中加入的试剂是:
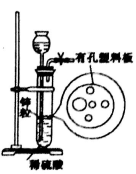
A. NaCl溶液 B. KNO3溶液 C. 浓氨水 D. 四氯化碳
难度: 中等查看答案及解析
-
下列各组中两个变化所发生的反应,属于同一类型的是( )
A. 由甲苯制甲基环己烷、由乙烷制溴乙烷
B. 乙烯使溴水褪色、乙炔使酸性高锰酸钾水溶液褪色
C. 由乙烯制聚乙烯、由氯乙烯制聚氯乙烯
D. 由苯制硝基苯、由乙醇制取乙酸乙酯
难度: 简单查看答案及解析