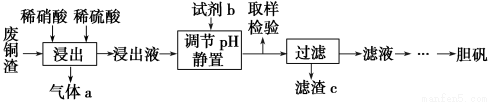
-
铜与一定量的浓硝酸反应,铜耗完时,生成硝酸铜溶液和NO、NO2 和N2O4的混合气体,这些气体与5.6LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸,则所消耗的铜的质量为( )g
A. 3.2 B. 64 C. 32 D. 12.8
难度: 困难查看答案及解析
-
对下列事实的解释正确的是( )
A. 氯气可以使湿润的有色布条褪色,是因为氯气具有漂白性
B. 常温下,浓H2SO4可以用铝制容器贮存,说明铝与浓H2SO4不反应盛放
C. 向50mL18mol•L -1的H2SO4溶液中加入足量的铜片加热充分反应后,被还原的H2SO4的物质的量等于0.45mol
D. 向某溶液中加入BaCl2溶液,生成白色沉淀,再加入稀盐酸,沉淀不溶解,则原溶液不一定含有SO42-
难度: 困难查看答案及解析
-
已知Am+ Bn+ Cm- Dn-具有相同的核外电子排布,(已知m>n)则下列说法正确的是( )
A. 原子序数C>D>A>B B. 原子半径B>A>D>C
C. 离子半径 Cm- > Dn-> Bn+ >Am+ D. D一定是第二周期元素
难度: 困难查看答案及解析
-
下列化合物可通过两种单质直接化合生成的是 ( )
A. FeCl2 B. SO3 C. NO2 D. Fe3O4
难度: 简单查看答案及解析
-
元素周期表和元素周期律对于其他与化学相关的科学技术有指导作用。下列说法中不正确的是( )
A. 在元素周期表左下方区域的金属元素中寻找半导体材料
B. 利用元素周期表中氟、氯、硫、磷附近的元素研制新型农药
C. 在过渡金属中寻找催化剂和耐高温、耐腐蚀的合金材料
D. 在周期表一定区域内寻找元素、发现物质的新用途是一种相当有效的方法
难度: 简单查看答案及解析
-
二氧化硫能使酸性高锰酸钾溶液褪色,说明二氧化硫具有( )
A. 酸性 B. 氧化性 C. 还原性 D. 漂白性
难度: 简单查看答案及解析
-
关于过氧化钠的说法正确的是( )
A. 过氧化钠在常温下的颜色为白色 B. 阴阳离子之比为1:1
C. 与水反应过氧化钠作氧化剂,水作还原剂 D. 1mol与足量的二氧化碳反应转移的电子数为NA
难度: 中等查看答案及解析
-
与氢硫酸反应有沉淀生成且为氧化还原反应的物质是( )
A. 稀硫酸 B. 氢氧化钠 C. 硫酸铜 D. 氯化铁
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.
、
、
三种核素的化学性质不同 B. 16O2、18O2彼此是同位素
C. 14N、14C两种核素的中子数相同,质子数不同 D. 白磷与红磷是磷元素的两种同素异形体
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. NO2溶于水时生成硝酸,故NO2是酸性氧化物
B. Fe(NO)2溶液中滴加盐酸溶液颜色有明显变化
C. 溴蒸汽和NO2都为红棕色气体,用湿润的淀粉-KI试纸可以鉴别
D. NO、CO在空气可以稳定存在
难度: 中等查看答案及解析
-
下列反应中反应物总能量低于生成物总能量的是( )
A. 乙醇燃烧 B. 碳酸钙分解 C. 铝粉与氧化铁粉末反应 D. 氧化钙溶于水
难度: 简单查看答案及解析
-
有关氨的说法不正确的是( )
A.
是10电子分子,呈三角锥型
B.
极易溶于水,可做喷泉实验;氨气易液化,液氨可用作制冷剂
C. 氨气溶于水能导电,所以氨气是电解质
D. 将过量的氨气通入氯化铝溶液中最终有白色沉淀生成
难度: 中等查看答案及解析
-
已知R2+离子有b个中子,核外有a个电子,表示R原子符合正确的是[ ]
A.
B.
C.
D.
难度: 中等查看答案及解析
-
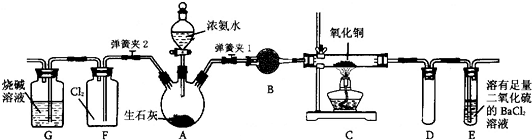
可以使用右图装置和指定试剂进行制备、干燥、收集的是( )
A. 用锌和稀硫酸制备
B. 用铜和稀硝酸制备
C. 用
水溶液和
制备
D. 用
和浓盐酸制备
难度: 中等查看答案及解析
-
下列离子方程式正确的是( )
A. 碳酸氢铵溶液与少量氢氧化钠溶液:NH
+HCO
+2OH-===NH3·H2O+CO
+H2O
B. 氯化铵溶液中加入少量稀氢氧化钠溶液:NH
+OH-===NH3↑+H2O
C. 氨水与盐酸反应:NH3·H2O+H+===NH
+H2O
D. 氨水中通入过量二氧化碳:2NH3·H2O+CO2===2NH
+CO
+H2O
难度: 困难查看答案及解析
-
固体A的化学式为NH5,它的所有原子的最外电子层结构都符合相应稀有气体的最外电子层结构,则下列有关说法不正确的是( )
A.1 mol NH5中含有5NA个N—H键(NA表示阿伏加德罗常数的数值)
B.NH5中既有共价键又有离子键
C.NH5的电子式为
D.NH5与水反应的化学方程式为NH5+H2O = NH3·H2O+H2↑
难度: 中等查看答案及解析
-
右下表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,W元素的核电荷数为X元素的2倍。下列说法正确的是( )
A. X、W、Z元素的原子半径及它们的气态氢化物的热稳定性均依次递增
B. Y、Z、W元素在自然界中均不能以游离态存在,它们的最高价氧化物的水化物的酸性依次递增
C. 根据元素周期律,可以推测T元素的单质具有半导体特性,T2X3具有氧化性和还原性
D. YX2晶体熔化、液态WX3气化均需克服分子间作用力
难度: 困难查看答案及解析
-
某元素R的最高价氧化物的水化物分子式是HnROm,则该元素对应的气态氢化物的化学式为( )
A. H8-n+mR B. H8-2m+nR C. H8-n+2mR D. H8-m+n
难度: 简单查看答案及解析