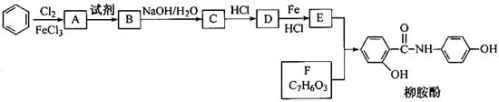
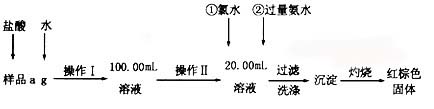
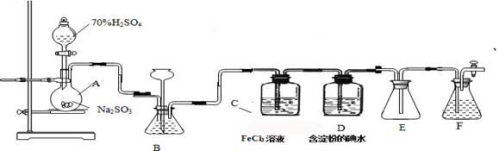
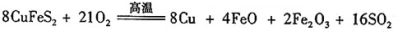-
“化学是一门中心学科,与社会、生活、科研密切的关系”。下列叙述中,不正确的是
A.大量使用燃煤发电是形成雾霾的主要原因
B.天然气、煤气大量泄漏遇到明火会爆炸
C.利用化学反应可实现12C到14C的转化
D.晶体硅可用于光伏发电、制造芯片
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列叙述正确的是
A.含有NA个氮原子的氮气在标准状况下的体积约为11.2L
B.25℃,1.01×105Pa,64gSO2中含有的原子数小于3NA
C.在常温常压下,11.2L Cl2含有的分子数为0.5NA
D.1 mo1 Na2O2与足量H2O反应,转移了2 NA 个电子
难度: 中等查看答案及解析
-
下列描述正确的是
A.氯气、SO2都能使品红溶液褪色,它们的漂白原理相同
B.滴加石蕊试液显红色的溶液:Fe3+、NH4+、I-可能大量共存
C.某溶液中加入盐酸酸化的氯化钡产生白色沉淀,原溶液中一定含有SO42-
D.Fe(NO3)2溶液中滴加少量稀硫酸会变黄色
难度: 简单查看答案及解析
-
下列有关溶液组成的描述合理的是
A.无色透明的溶液中:
、K+、Na+、MnO4-
B.酸性溶液中可能大量存在Na+、ClO
、SO42-、I
C.含有0.1 mol
Fe3+ 的溶液中可以大量存在:K+、Mg2+、I-、NO3-
D.室温下,PH=l的溶液中一定可以存在:Na+、Fe3+、NO3-、SO42-
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A.钠与水反应:
B.硅酸钠溶液与醋酸溶液混合:
+
C.0.01mol/LNH4Al
溶液与0.02mol/LBa(OH)2溶液等体积混合:
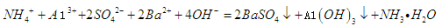
D.向次氯酸钙溶液通入
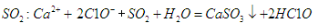
难度: 中等查看答案及解析
-
下列有关化学实验叙述正确的是
A.容量瓶、滴定管、分液漏斗使用前都必须检查是否漏水
B.用98%的浓硫酸配制100g10%的稀硫酸时,除使用量筒外还需用到容量瓶
C.在钠跟水反应的实验中,切下绿豆粒大小的钠投入水中进行实验,剩余的钠块丢弃到废料桶中
D.若FeCl2溶液中含有I-杂质,可用过量Cl2氧化后进行萃取分液
难度: 简单查看答案及解析
-
N、O、Si、S是重要的非金属元素,下列说法正确的是
A.N、O、S、Si的原子半径逐渐增大,非金属性逐渐减弱
B.氮的氧化物和硫的氧化物既是形成光化学烟雾,又是形成酸雨的主要物质
C.S、SO2和Si、SiO2四种物质均能与NaOH溶液反应,各自又能与某些酸反应
D.N、Si、S的单质均能和氧气反应,生成的产物分别是NO2、SiO2和SO2
难度: 简单查看答案及解析
-
下列叙述中,正确的是
A.用丁达尔现象实验可以区分食盐水和淀粉溶液
B.氨气的水溶液能导电,所以氨气是电解质
C.NO2、SO2溶于水都发生氧化还原反应
D.Fe分别与氯气和稀盐酸反应可得到同一种氯化物
难度: 中等查看答案及解析
-
下列各组指定物质的同分异构体数目相等的是
A.乙烷的二氯代物和丙烷的一氯代物
B.丙烷的一氯代物和戊烷
C.苯的二氯代物和苯的一硝基代物
D.C3H6和C5H12
难度: 中等查看答案及解析
-
下列鉴别、分离或除杂方法中正确的是
A.苯中含有少量苯酚,可用NaOH溶液除去
B.NaOH固体中混有NH4HCO3,可直接加热除去NH4HCO3
C.鉴别甲苯与己烯,可滴加酸性KMnO4溶液
D.鉴别某溶液是否含有Fe2+,可先滴加新制氯水,再滴加KSCN溶液
难度: 中等查看答案及解析
-
下列说法正确的是
A.氯化铁溶液有较强氧化性,故可用作净水剂
B.煤中含有大量的有机物,用干馏的方法通过发生物理变化得到产物
C.除去CH4中的少量C2H4:通过盛有酸性高锰酸钾溶液的洗气瓶
D.将ag铜丝灼烧成黑色后趁热插入乙醇中,铜丝变红,再次称量质量等于a g
难度: 中等查看答案及解析
-
下列实验操作与预期实验目的或所得实验结论一致的是
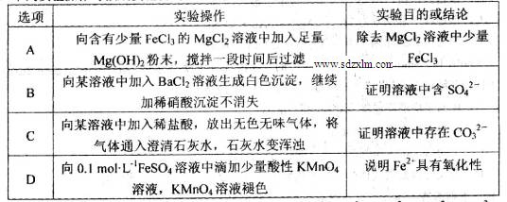
难度: 中等查看答案及解析
-
水溶液X中只可能溶有K+、Mg2+、Al3+、[Al(OH)4]-、SiO32-、CO32-、SO32-、SO42-中的若干种离子。某同学对该溶液进行了如下实验:下列判断正确的是
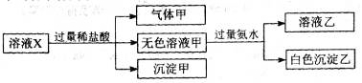
A.气体甲一定是纯净物
B.沉淀甲是硅酸和硅酸镁的混合物
C.K+、
和
一定存在于溶液X中
D.
一定不存在于溶液X中
难度: 中等查看答案及解析
-
下列图示实验正确的是
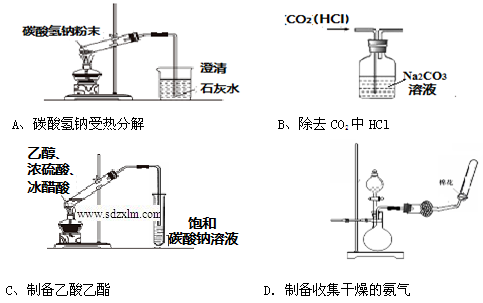
难度: 中等查看答案及解析
-
X、Y、Z是位于不同周期的三种短周期元素,且原子序数逐渐增大,X、Z属于同一主族,三种元素可以形成原子个数比为1:1:1的化合物W。下列推测正确的是
A.元素Z的氧化物一定属于碱性氧化物
B.原子半径关系是:X<Y<Z
C.三种元素中,Y的金属性最强
D.Y、Z都能形成含氧酸,且前者的酸性比后者酸性强
难度: 中等查看答案及解析
-
学家研制出多种新型杀虫剂代替DDT,化合物M是其中的一种。下列关于M的说法错误的是
A.M的分子式为C15H22O3
B.与FeCl3溶液发生反应后溶液不显紫色
C.M可以发生银镜反应
D.1molM最多与1molH2完全加成
难度: 中等查看答案及解析
-
高铁酸钠(Na2FeO4)是一种新型、高效、多功能水处理剂,是比Cl2、O3、ClO2、KMnO4氧化性更强、无二次污染的绿色水处理剂。工业制高铁酸钠的方法有如下两种:
湿法制备的主要离子反应为:2Fe(OH)3 +3ClO—+4OH— =2FeO42— +3Cl— +5H2O ,
干法制备的主要反应方程为:2FeSO4 +6Na2O2 = 2Na2FeO4 +2Na2O +2Na2SO4 +O2↑
则下列有关说法不正确的是
A.高铁酸钠中铁显+6价
B.湿法中FeO42—是氧化产物
C.干法中每生成1mol Na2FeO4 转移4mol电子
D.K2FeO4可氧化水中的H2S、NH3,生成的Fe(OH)3胶体还能吸附悬浮杂质
难度: 中等查看答案及解析
-
现将1mo1Cu2S与144克FeO投入到足量稀硝酸溶液中,充分反应得到Fe(NO3)3、Cu(NO3)2 、CuSO4的混合溶液,并产生NO气体。则最终反应所得NO物质的量为
A.4 mo1 B.5 mo1 C.6 mo1 D.7 mo1
难度: 中等查看答案及解析
-
(11分)A+B→X+Y+ H2O(为配平,反应条件略去)是中学常见反应的化学方程式,其中A、B的物质的量之比为1:4.请回答:
(1)若Y是黄绿色气体,该反应的化学方程式是 .
(2)若A为非金属单质,构成它的原子核外最外层电子数是次外层电子数的2倍,B的溶液为某浓酸,则 反应中氧化剂与还原剂的物质的量之比是 .
(3)若A为金属单质,常温下A在B的浓溶液中“钝化”,且A可溶于X溶液中.
①A元素在周期表中的位置是______ (填所在周期和族);Y的化学式是______.
②含a mol X的溶液溶解了一定量A后,若溶液中两种金属阳离子的物质的量恰好相等,则被还原的X是______ mol.
(4)若A、B、X、Y均为化合物.A溶于水电离出的阳离子和水作用的生成物可净化水,向A溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀;B的焰色为黄色.则向A中逐滴加入B的离子方程式为
难度: 中等查看答案及解析