-
下列说法正确是
A. “榆荚只能随柳絮,等闲缭乱走空园”中“柳絮”的主要成分为蛋白质
B. “纷纷灿烂如星陨,赫赫喧雁似火攻”中烟花是某些金属的焰色反应,属于化学变化
C. 向蛋清中加入饱和(NH4)2SO4,蛋白质的溶解度减小
D. 我国自主研制的新型航天服面料的主要化学成分是由碳化硅陶瓷和碳纤维复合而成的,它属于有机高分子化合物
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值。下列叙述中正确的是
A. 1.00 mol NaCl中含有NaCl分子数为NA
B. 18g D2O和18g H2O中含有的质子数均为10NA
C. 1mol Fe高温条件下与水蒸反应,电子转移数为3NA
D. 12g石墨烯(单层石墨)中含有六元环的个数为0.5 NA
难度: 中等查看答案及解析
-
对下列四种有机物的有关说法正确的是
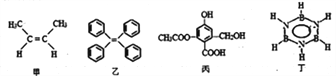
A. 甲的名称为反-2-丁烯
B. 乙中所有碳原子一定处于同一平面
C. 1mol丙分别与足量Na、NaOH、NaHCO3反应,消耗这三种物质分别是3mol、4mol、1mol
D. 丁的二氯代物有3种
难度: 中等查看答案及解析
-
下表中各栏目的叙述对应都正确的一项是
选项
叙述
实验现象
解释
A
反萃取法提取碘的CCl4溶液中的碘
向富碘的CCl4溶液中加入足量水、振荡、静置、分液
碘在水中溶解度比在CCl4中大
B
在FeCl3溶液中加入适量Fe粉充分反应后,再滴加几滴铁氧化钾溶液
产生蓝色沉淀
2Fe3++Fe=3Fe2+ 3Fe2++2[Fe(CN)6]3-=
Fe3[Fe(CN)6]2↓
C
向0.1 molL的Fe(NO3)2溶液中滴 加盐酸
振荡试管颜色加深
H+抑制Fe2+水解
D
向5ml 0.1mol/LNaOH溶液滴入5 滴0.1mol/LMgSO4溶液,再滴加0.1 mol/L CuSO4溶液
先有白色沉淀生成,后变为浅蓝色沉淀
Cu(OH)2的溶度积比Mg(OH)2的小
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次增大。四种元素形成的单质依次为m、n、p、q;这些元素组成的二元化合物r、t、u,其中u为形成酸雨的主要物质之一;25℃时,0.01mol/L的v溶液中pH=12。上述物质的转化关系如图所示。下列说法正确的是
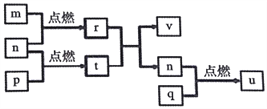
A. 原子半径的大小: W>Z>Y>X
B. v能抑制水的电离而u能促进水的电离
C. 粘有q的试管可用酒精洗涤
D. Z分别与Y、W组成的化合物中化学健类型可能相同
难度: 中等查看答案及解析
-
我国科学家在天然气脱硫研究方面取得了新进展,利用如图装置可发生反应H2S+O2=H2O2+S,已知甲池中发生的反应为
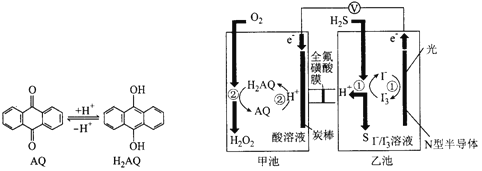
下列说法正确的是( )
A. 该装置中电能转化为光能
B. H+从甲池移向乙池
C. 甲池中碳棒上发生的电极反应为AQ+2H+-2e-=H2AQ
D. 乙池溶液屮发生的反应为H2S+I3-=3I-+S+2H+
难度: 困难查看答案及解析
-
在常温下,用0.1000 mol/L的盐酸滴定25 mL 0.100 mol/Lna2CO3溶液,所得滴定曲线如下图所示。下列相关微粒浓度间的关系不正确的是
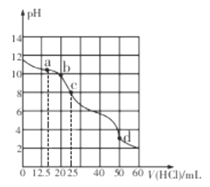
A. a点: c(CO32-) >c(Cl-)> c(HCO3-)
B. b点: c(Na+)+c(H+)= c(Cl-)+ c(HCO3-)+2c(CO32-)+c(OH-)
C. c点: c(OH-)+ c(CO32-)= c(H+) +c(H2CO3)
D. d点: c(Cl-)= c(Na+)
难度: 中等查看答案及解析
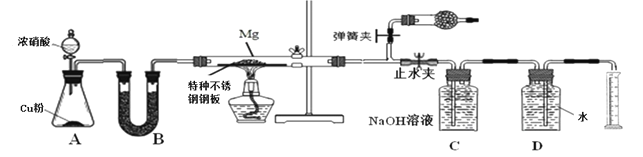



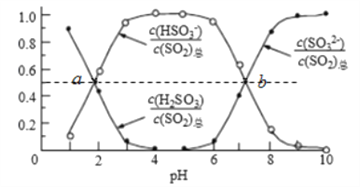

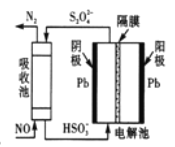
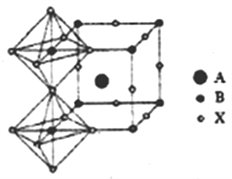
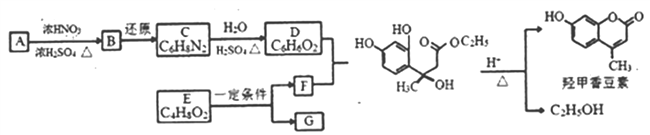 己知: (1)
己知: (1)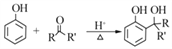
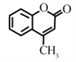 的合成路线(其他试剂任选) _____
的合成路线(其他试剂任选) _____