-
下列关于日常生活中的化学问题判断正确的是( )
A.为了保证食品的卫生和绿色,在食品中不能添加任何化学添加剂
B.在人类必须的三大营养素糖类、油酯、蛋白质中,油酯是热能最高的营养素
C.用硬水洗涤衣物时,肥皂比合成洗涤剂有更好的去污效果
D.用于盛装食品的塑料袋是其主要成分是聚氯乙烯难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数,下列说法正确的是( )
A.0.2molCaC2固体中有0.2NA个阴离子
B.1.0L 1.0mol/LNa2CO3溶液中,CO32-数为NA
C.标准状况下,11.2 L氯仿中含有的C-Cl键的数目为1.5NA
D.1molCl2参加反应,转移电子数一定为2NA个难度: 中等查看答案及解析
-
下列说法正确的是
①电解质溶液导电过程属于化学变化过程
②稀有气体不活泼的原因是因为它们原子的最外层都达到8电子的稳定结构
③FeC13、SO3、NO三种物质都可以通过化合反应制取
④SiO2是制造光导纤维的材料( )
A.①②
B.③④
C.①②③
D.①③④难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是( )
A.向澄清石灰水滴加稀硫酸:2H++SO42-+Ca(OH)2=2H2O+CaSO4↓
B.硫化亚铁与溶于稀硝酸:FeS+2H+=Fe2++H2S↑
C.氢氧化铝中和胃酸:Al(OH)3+3H+=Al3++3H2O
D.小苏打与氢氧化钠溶液混合:HCO3-+OH-=CO2↑+H2O难度: 中等查看答案及解析
-
下列实验或操作合理的是( )
A.在250mL烧杯中,加入216mL水和24gNaOH固体,配制10%NaOH溶液
B.用乙醇和浓硫酸除去乙酸乙酯中的少量乙酸
C.在硫酸铜结晶水含量的测定实验中,称量操作最少进行4次
D.鉴定SO32-向溶液中加入硝酸酸化的氯化钡溶液难度: 中等查看答案及解析
-
夜色中常看到小朋友手持被称为“魔棒”的荧光棒玩耍,“魔棒”发光原理是利用过氧化氢氧化草酸二酯产生能量,该能量被传递给荧光物质后便发出荧光,草酸二酯(CPPO)结构简式为:下列有关说法不正确的是( )
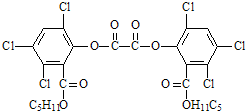
A.草酸二酯属于芳香族化合物
B.草酸二酯的分子式为C26H24O8Cl6
C.草酸二酯苯环上氢原子被一个溴原子取代的产物只有一种
D.1mol草酸二酯与氢氧化钠稀溶液反应(苯环上卤原子不水解),最多消耗4molNaOH难度: 中等查看答案及解析
-
下列溶液中各微粒的浓度关系正确的是( )
A.25℃时,物质的量浓度相等的Na2CO3和CH3COONa溶液的pH值:Na2CO3>CH3COONa
B.某二元弱酸的酸式盐NaHA溶液中:c(H+)+c(Na+)=c(OH-)+c(HA-)+c(A2-)
C.1.0mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3)
D.向氟化钠溶液中加入适量氢氟酸,得到的酸性混合溶液:c(F-)>c(Na+)>c(H+)>c(OH-)难度: 中等查看答案及解析
-
短周期元素X和Y,X原子的电子层数为n,最外层电子数为(2n+1),Y原子最外层电子数是次外层电子数的3倍.下列说法一定正确的是( )
A.X和Y都是非金属元素,其中X的最高化合价为+5价
B.元素X可形成化学式为KXO3的盐
C.X与Y所能形成的化合物都是酸性氧化物
D.X的氢化物极易溶于水,可以用来做喷泉实验难度: 中等查看答案及解析
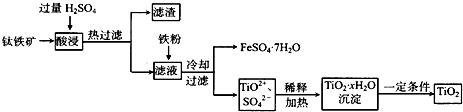
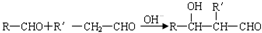 .有机物G(C20H18O4)是一种酯,合成路线如下:
.有机物G(C20H18O4)是一种酯,合成路线如下: