-
生活中的某些问题常常涉及到化学知识,下列叙述不正确的是
A.棉、麻、羊毛及合成纤维完全燃烧都只生成CO2和H2O
B.家庭中不宜用铝合金容器长期存放咸的食品
C.水处理常用到明矾和漂白粉,但二者的作用原理不同
D.黄河入海口沙洲的形成体现了胶体聚沉的性质
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说正确的是
A.1 L 0.1 mol/L 醋酸中含有CH3COO-数目等于0.1NA
B.室温下,1 L pH=13的NaOH溶液中,由水电离的OH-数目为0.1NA
C.1 L 0.1 mol·L-1 Na2CO3溶液中含碳微粒总数一定为0.1NA
D.1 L 0.1 mol·L-1 Al2(SO4)3溶液中Al3+的数目为0.2NA
难度: 简单查看答案及解析
-
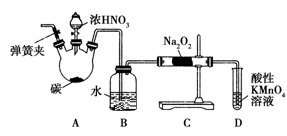
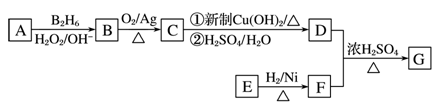
如图是某研究小组采用电解法处理石油炼制过程中产生的大量H2S废气的工艺流程。该方法对H2S的吸收率达99%以上,并可制取H2和S。下列说法正确的是

A.吸收H2S的离子方程式为Fe3++H2S=Fe2++S↓+2H+
B.电解过程中的阳极反应主要为2Cl--2e-=Cl2↑
C.该工艺流程体现绿色化学思想
D.实验室可用点燃充分燃烧的方法消除H2S污染
难度: 困难查看答案及解析
-
下列装置应用于实验室制氯气并回收氯化锰的实验,能达到实验目的的是
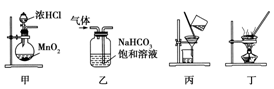
A.用装置甲制取Cl2 B.用装置乙除去Cl2中的少量HCl
C.用装置丙分离MnO2和MnCl2溶液 D.用装置丁蒸干MnCl2溶液制MnCl2·4H2O
难度: 中等查看答案及解析
-
下列关于离子方程式的评价正确的是
选项
离子方程式
评价
A
将2 mol Cl2通入到含1 mol FeI2的溶液中:
2Fe2++2I-+2Cl2===2Fe3++4Cl-+I2
正确;
Cl2过量,Fe2+、I-均被氧化
B
用Cu作电极电解NaCl溶液,阳极的电极反应式:
2Cl--2e-===Cl2↑
正确;
Cl-优先于OH-放电
C
过量SO2通入到NaClO溶液中:
SO2+H2O+ClO-=HClO+HSO3-
正确;
H2SO3的酸性强于HClO
D
Mg(HCO3)2溶液与足量的NaOH溶液反应:
Mg2++2HCO3-+4OH-=Mg(OH)2↓+2CO32-+2H2O
正确;
Mg(OH)2比MgCO3更难溶
难度: 困难查看答案及解析
-
几种短周期元素的原子半径及主要化合价如下表所示:
元素符号
X
Y
Z
W
原子半径/pm
160
143
70
66
主要化合价
+2
+3
+5、+3、-3
-2
下列说法中正确的是
A.一定条件下,Z的单质与W的常见单质直接生成ZW2
B.Z最高价氧化物对应水化物与其氢化物能发生化合反应生成离子化合物
C.Y的最高价氧化物对应水化物能溶于氨水
D.相同条件下,X、Y的单质分别与盐酸反应时,后者反应剧烈些
难度: 中等查看答案及解析
-
某有机物的分子式为C4H8O2,下列有关其同分异构体数目的说法中错误的是
A.属于酯类的有4种 B.属于羧酸类的有2种
C.既含有羟基又含有醛基的有3种 D.存在分子中含有六元环的同分异构体
难度: 中等查看答案及解析