-
下列叙述错误的是
A.Al2(SO4)3可除去酸性废水中的悬浮颗粒
B.氯气与石灰乳反应能得到含氯漂白剂
C.燃煤时加入适量石灰石,可减少废气中SO2的排放
D.工业上硝酸可用于制化肥、炸药和染料等
难度: 简单查看答案及解析
-
下列各组物质所发生的化学反应中,由于反应物的用量不同而得到不同产物的是
①铁与稀硝酸 ②碘化亚铁溶液与溴水 ③碳酸钠溶液与稀盐酸 ④铁与氯气
A.①②③ B.①②③④ C.②③ D.③④
难度: 中等查看答案及解析
-
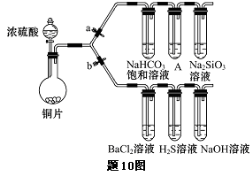
“封管实验”具有简易、方便、节约、绿色等优点,观察下面四个“封管实验”(夹持装置未画出),判断下列说法正确的是
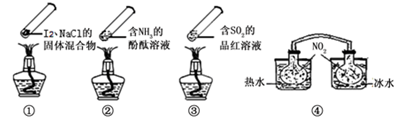
A.加热时,①上部汇聚了固体碘,说明碘的热稳定性较差
B.加热时,②、③中的溶液均变红,冷却后又都变为无色
C.四个“封管实验”中都有可逆反应发生
D.④中,浸泡在热水中的容器内气体颜色变深,浸泡在冰水中的容器内气体颜色变浅
难度: 中等查看答案及解析
-
设NA是阿伏加德罗常数的数值,下列说法正确的是
A.0.1 mol羟基中含有的电子数为0.7 NA
B.28g Fe与足量稀硝酸反应,转移的电子数为NA
C.将58.5g NaCl溶于1 L水中,溶液中所含Na+和Cl-总数为2NA
D.0.5 mol/L Al2(SO4)3溶液中含有SO42 -的数目为1.5 NA
难度: 简单查看答案及解析
-
下列关于热化学反应的描述中正确的是
A.已知H+(aq)+OH-(aq)== H2O(l) ΔH=-57.3 kJ·mol-1,则H2SO4和Ba(OH)2反应的反应热ΔH=2×(-57.3) kJ·mol-1
B.葡萄糖的燃烧热是2800 kJ·mol-1,则1/2C6H12O6(s)+3O2(g)==3CO2(g)+3H2O(l) ΔH=1400 kJ/mol
C.H2(g)的燃烧热是285.8 kJ·mol-1,则2H2O(g)==2H2(g)+O2(g) ΔH=+571.6 kJ·mol-1
D.燃料电池中将甲醇蒸气转化为氢气的热化学方程式是:CH3OH(g)+1/2O2(g)== CO2(g)+2H2(g)ΔH=-192.9 kJ·mol-1,CH3OH(g)的燃烧热为192.9 kJ·mol-1
难度: 中等查看答案及解析
-
PASS是新一代高效净水剂,它由X、Y、Z、W、R五种短周期元素组成,五种元素原子序数依次增大。X原子是所有原子中半径最小的,Y、R同主族,Z、W、R同周期,Y原子的最外层电子数是次外层的3倍。Z是常见的金属,其原子的电子层数等于主族序数。W单质是人类将太阳能转变为电能的常用材料。下列说法正确的是
A.原子半径按X、Y、Z、R、W的顺序依次增大
B.WY2能与碱反应,但不能与任何酸反应
C.Z与Y形成的化合物可作为耐高温材料
D.熔沸点:X2R > X2Y
难度: 中等查看答案及解析
-
利用下图装置可以模拟铁的电化学防护。下列说法不正确的是
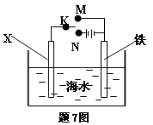
A.若X为锌棒,开关K置于M处,可减缓铁的腐蚀
B.若X为锌棒,开关K置于M处,铁极发生氧化反应
C.若X为碳棒,开关K置于N处,可减缓铁的腐蚀
D.若X为碳棒,开关K置于N处,X极发生氧化反应
难度: 简单查看答案及解析