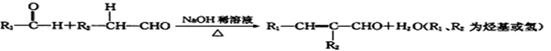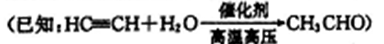-
化学与生活、社会发展息息相关,下列说法正确的是
A. 洗涤剂除油污的原理与热碱液除油污的原理相同
B. 食品包装内放置生石灰与放置硅胶的作用相同
C. 聚乙烯和聚氯乙烯的单体相同
D. 自来水中加入漂白粉与加入硫酸铝的作用相同
难度: 中等查看答案及解析
-
用NA表示阿伏伽德罗常数的数值,下列说法正确的是
A. 1molNa218O2中所含的中子数为42NA
B. 9.8g由H2SO4和H3PO4组成的混合物中含有的氧原子数为0.4NA
C. 2mol·L-1的FeCl3溶液溶液中含有的Fe3+数目小于2NA
D. 1mol环己烷中含有的共价键数为12NA
难度: 困难查看答案及解析
-
TPE及其衍生物具有诱导发光特性,在光电材料等领域应用前景广泛。TPE的结构简式如图,下列关于TPE的说法正确的是
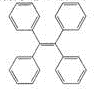
A. TPE属于苯的同系物
B. TPE能发生加成反应,但不能取代反应
C. TPE与化合物
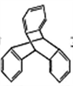 互为同分异构体
互为同分异构体D. TPE的一氯代物有3种
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次递减,四种元素中没有同族元素,其原子的最外层电子数之和为15, W与X、Y、Z位于相邻周期,X原子的最外层电子数是W原子内层电子总数的3倍,单质Z可与水剧烈反应,Y、Z均为金属元素。下列叙述正确的是
A. 原子半径:Y>Z
B. 单质熔点:W>X
C. X、Y的氧化物均能与Z的氧化物对应的水化物反应
D. X、W的最简单氢化物的水溶液均显酸性
难度: 困难查看答案及解析
-
下列实验操作和现象对应的结论错误的是
选项
实验操作和现象
结论
A
向溶液X中滴加BaCl2溶液,有白色沉淀生成
溶液X中可能含有SO42-
B
物质的量之比为2:3的稀硝酸和稀硫酸
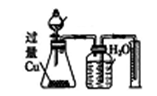
反应结束后,锥形瓶中溶液的溶质是CuSO4,集气瓶中收集到的气体是NO
C
向1mL浓度均为0.05mol·L-1NaCl、NaI的混合溶液中滴加2滴0.01mol·L-1AgNO3溶液,振荡,沉淀是黄色
Ksp(AgCl)<Ksp(AgI)
D
室温下,用pH试纸测得0.1mol·L-1 NaHSO3溶液的pH约为5
HSO3-的电离程度大于其水解程度
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
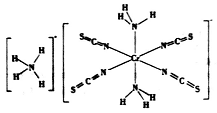
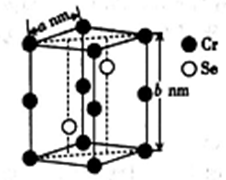
以铬酸钾(K2CrO4)为原料用电化学法制备K2Cr2O7的装置如图,下列说法正确的是
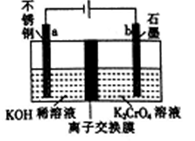
A. a极的电极反应为:2H2O+2e-=2OH-+H2↑
B. 电解过程中氢氧化钾溶液的浓度保持不变
C. b极上CrO42-发生氧化反应生成Cr2O72-
D. 电解过程中H+从右侧通过离子交换膜迁移到左侧
难度: 困难查看答案及解析
-
常温下,用0.10mol·L-1的NaOH溶液分别滴定体积均为50.00mL、浓度均为0.05mol·L-1的HClO、HF两种溶液,其滴定曲线如图所示。
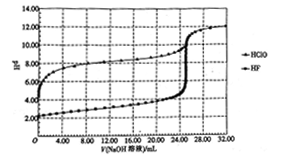
下列说法正确的是
A. HClO的酸性比HF强
B. V(NaOH溶液)=0 mL 时,对应溶液中:c(ClO-)=c(F-)
C. V(NaOH溶液)=12.50 mL 时,对应溶液中:c(ClO-)>c(F-)
D. V(NaOH溶液)=25.00mL时,对应溶液中:c(ClO-)<c(F-)
难度: 困难查看答案及解析


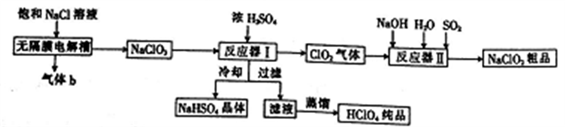
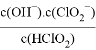 =__________。
=__________。