-
中和反应在生活生产中有广泛的应用,下列做法不是利用中和反应原理的是
A. 用熟石灰改良酸性土壤
B. 用含氢氧化镁的药物治疗胃酸过多
C. 用盐酸除去铁锈
D. 用氨水(NH3·H2O)处理工厂污水中的硫酸
难度: 中等查看答案及解析
-
分析推理是化学学习过程中的常用方法。下列推理正确的是( )
A. 纯碱的水溶液呈碱性,所以纯碱属于碱类
B. 分子、原子可以构成物质,所以物质一定是由分子、原子构成的
C. 酸碱中和反应生成盐和水,所以生成盐和水的反应一定是中和反应
D. 化合物是含有不同种元素的纯净物,所以含有不同种元素的纯净物一定是化合物
难度: 中等查看答案及解析
-
下列说法中正确的是( )
A. 中和反应一定是复分解反应
B. 生成盐和水的反应一定是中和反应
C. 复分解反应也叫中和反应
D. 中和反应与复分解反应是两种不同基本类型的反应
难度: 简单查看答案及解析
-
下列实验操作中正确的是( )
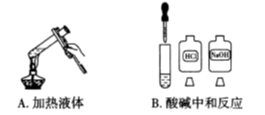
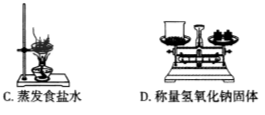
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
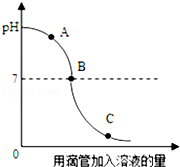
某化学兴趣小组利用稀盐酸和氢氧化钠溶液来探究中和反应的规律时,其溶液的pH随时间的变化如图所示,则a点表示溶液中的溶质是( )

A. HCl NaOH B. NaCl C. NaCl NaOH D. NaCl HCl
难度: 中等查看答案及解析
-
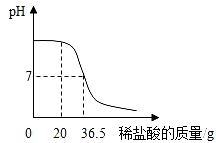
室温时,随着向盛有稀硫酸的烧杯中逐滴加入Ba(OH)2溶液,烧杯内溶液中的溶质质量变化如图所示(忽略溶液温度的变化),下列分析正确的是( )
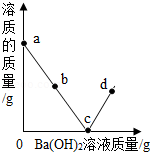
A. a点溶液中有两种溶质
B. b点溶液中滴加紫色石蕊溶液,溶液变蓝
C. c点烧杯内液体的pH=7
D. d点溶液中较多的Ba2+、OH﹣、SO42﹣、H+
难度: 困难查看答案及解析
-
向一定量的Ba(OH)2溶液中滴加稀H2SO4,下列图象能正确描述对应关系的是( )
A.
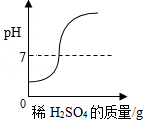 B.
B. 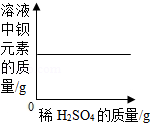
C.
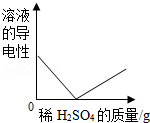 D.
D. 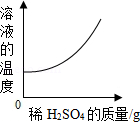
难度: 困难查看答案及解析