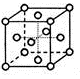
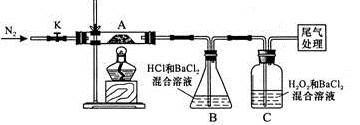
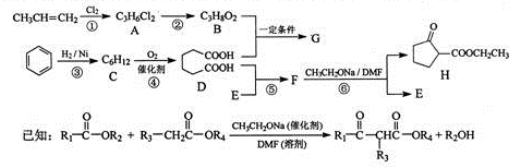
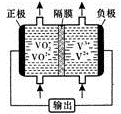
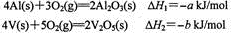-
SO2有毒,但葡萄酒里都含有SO2,起保鲜、杀菌和抗氧化作用。下列说法不正确的是
A.葡萄酒中的SO2对人体无害,是因为它的含量很少
B.葡萄酒中的SO2具有抗氧化作用,是因为它具有较强的还原性
C.从红葡萄酒的颜色判断,其中的SO2没有漂白性
D.葡萄酒倒入酒杯摇一摇,可以减少其中SO2的含量
难度: 中等查看答案及解析
-
下列物质分类正确的是
A.NO2、Cl2O7都是酸性氧化物 B.水银、水玻璃都是混合物
C.HD、HCHO都是极性分子 D.干冰、可燃冰都是分子晶体
难度: 简单查看答案及解析
-
下列有关FeBr2溶液的叙述错误的是
A.滴加KI淀粉溶液变为蓝色
B.该溶液中
可以大量共存
C.与硝酸酸化的AgNO3溶液反应有沉淀生成并放出气体
D.向该溶液中通入过量Cl2,反应的离子方程式:
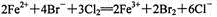
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法不正确的是
A.46 g C2H6O中含有的C-H键数一定为5 NA
B.常温常压下,17 g甲基(一14CH3)所含电子总数为9NA
C.标准状况下,11.2.L C02和乙炔的混合气体所含π键数目为NA
D.CO2气体与足量的Na2O2反应,固体增重28 g时转移了NA 个电子
难度: 中等查看答案及解析
-
下列实验操作、现象和结论均正确的是

难度: 中等查看答案及解析
-
常温下,将Cl2缓慢通入水中至饱和,然后向其中滴加0.l mol·L-l NaOH溶液。整个实验过程中溶液的pH变化曲线如图所示,不考虑次氯酸分解,下列叙述正确的是
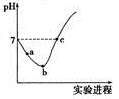
A.实验过程中用pH试纸测定溶液的pH
B.a~b段,溶液中
减小
C.b点对应溶液中:c(Cl-)> c(H+)> c(HClO) >c(ClO-)>c(OH-)
D.c点对应溶液中:c(Na+)=2c(ClO-)+c(HClO)
难度: 困难查看答案及解析
-
已知反应X(g)+Y(g)
R(g)+Q(g)的平衡常数与温度的关系如下表。830℃时,向一个2L的密闭容器中充入0.2 molX和0.8 mol Y,反应初始4s内v(X)=0.005mol/(L·s)下列说法正确的是

A.4s时容器内c(Y)=0.76 mol/L
B.830℃达平衡时,X的转化率为80%
C.反应达平衡后,升高温度,平衡正向移动
D.1 200℃时反应R(g)+Q(g)
X(g)+Y(g)的平衡常数K=0.4
难度: 困难查看答案及解析