-
A~L为中学化学常见物质,其主要转化关系如下图所示(其中产物水已略去)。已知A为金属单质,C、D通常状况下为气体单质。B、F均为重要的化工产品,F为具有刺激性气味的气体,将一定量F通入B的稀溶液中可以得到两种盐K和L。G和I分别由相同的两种元素组成,通常状况下均为无色液体。

(1)B的化学式为________;工业上冶炼金属A的方法称为________。
(2)向E的溶液中加入氢氧化钠溶液的实验现象为________,反应的化学方程式为________。
(3)写出E的酸性溶液与G反应转化为H的离子方程式________。
(4)相同条件下物质的量浓度相同的K、L溶液的pH大小关系为K________L(用“>”、“<”或“=”表示),其主要原因是(用化学用语说明)________。
-
某化学课外活动小组的同学利用原电池原理探究一定温度下(实验时实际的环境温度)使铁钝化的硝酸的最低浓度。

实验步骤如下:
①向两支具支试管中分别加入浓硝酸5.0mL(质量分数为65%,
密度为1.4g/mL)。按图组装好实验装置。
②将铜丝和铁丝同时插入浓硝酸中,观察到灵敏电流计指针先指向铜丝,但又迅速反转(只需1—2s)指向铁丝一端。
③用盛有5.0mL蒸馏水的注射器向具支试管内加水,并注视电流计的指针偏转方向。在指针恰好发生反转又指向铜丝时停止
实验,记录此时已注入的水的体积。
重复三次实验获得的数据如下:
| 实验次数 | 实验温度(℃) | 注入水的体积(mL) |
| 1 | 17.2 | 2.4 |
| 2 | T1 | 2.5 |
| 3 | T2 | 2.3 |
请回答下列问题:
(1)在该装置中仪器a因其作用而称为________;指针指向铁丝时,铁丝为________极(填“正”或“负”)
(2)65%的硝酸的物质的量浓度是________;在未注水前正极的电极反应式为________。
(3)T1________T2(填“>”、“<”或“=”)
(4)在本实验温度下,使铁钝化的硝酸最低浓度为________%;利用本实验数据判断,若以45%的硝酸进行实验(不再注水),则电流表的指针应指向________电极(填“铁”或“铜”)
(5)该实验装置上的不足是________,改进方法是________。
-
X、Y为两种主族元素,原子序数X小于Y,它们与元素Se三种元素原子序数之和为56。已知:X有两种氧化物M和N。Y与Se是相邻周期同主族元素,其中Se可以从电解精炼铜的阳极泥中获得。从阳极泥中提取Se的流程如下:
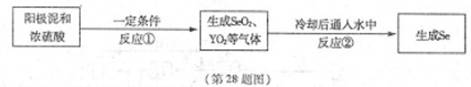
回答下列问题:(各元素用相应的元素符号表示)
(1)写出X和Y形成的化合物的电子式________。
(2)阳极泥中Se以单质、Ag2Se、Cu2Se等形式存在。写出①中Se单质与浓硫酸反应的化学方程式。
(3)写出反应②的化学方程式为________。
(4)某温度下在容积固定的密闭容器中,下列反应达到平衡:M(g)+H2O(g) N(g)+H2(g)
N(g)+H2(g)
| n(M):n(H2O) | M转化率 | H2O转化率 |
| 1:1 | 0.5 | 0.5 |
| 1:2 | 0.67 | 0.335 |
| 1:3 | 0.75 | 0.25 |
①已知M和H2的燃烧热分别为283kJ/mol、285.8kJ/mol,H2O(g)=H2O(l)△H=—44kJ/mol,
写出上述反应的热化学方程式________。
②该反应的平衡常数为________。该温度下,向容器中充入1molM、3mol H2O、2mol N、1.5molH2,则起始时该反应速率V正________V逆(填“>”、“<”或“=”)
③结合表中数据判断下列说法中正确的是________
A.增加H2O(g)的量,M的转化率升高而H2O(g)的转化率降低
B.若M与H2O(g)的转化率相同时,二者的初始投入量一定相同
C.M和H2O(g)初始物质的量之比等于二者转化率之比
D.当M与H2O(g)物质的之比为1:4时,M的转化率为0.85
-
晶体硅是信息科学和能源科学的一种重要材料,可用作制芯片和太阳能电池等。下列流程图是工业上制取纯硅的一种方法:

请回答下列问题:(各元素用相应的元素符号表示)
(1)在上述生产过程中,属于置换反应的有(填反应的代号“I~IV”)
(2)A、B、C三种气体,在上述生产过程中可循环利用的是________;在“节能减排”中作为减排目标的一种气体是________。
(3)化合物甲的用途很广,有些已应用于高、精、尖科技领域。通常可作建筑工业和造纸工业上的黏合剂,可作肥皂的填料,是天然水的软化剂。将石英砂和纯碱按一定比例混合加热至1373~1623K反应生成化合物甲,其化学方程式为。
(4)利用反应III能制得纯硅的原因是________。
(5)已知反应IV中产物的总能量比反应物的总能量低,则在密闭容器内反应IV建立平衡,改变下列的一个条件,气体B的物质的量增大的是________。
a.缩小容器的容积
b.降低反应体系的温度
c.加入少量NaOH固体(生成物在此温度下不分解)
d.加入少量催化性能更好的催化剂
(6)金属镍(Ni)与气体A能形成常温下为液态的Ni(A)4、利用Ni(A)4的生成与分解可以制得纯度很高的纳米镍,写出Ni(A)4在423K分解的化学方程式________
-
A、B、C、D为原子序数依次增大的短周期元素。A原子核外电子有5种运动状态,B是地壳中含量最多的元素,A、C、D未成对电子数比为1:3:1。E有“生物金属”之称,E4+和氩原子的核外电子排布相同,请回答下列问题:(各元素用相应的元素符号表示)

(1)五种元素所形成的XY3型化合物的化学式可能为________,
其中心原子杂化方式依次为________。
(2)在元素周期表中与C同周期但不同区的金属元素有________种。
(3)B与D形成的以D为中心三原子分子中,B的质量分数约为47%,则分子的空间构型为________。
(4)E的一种氧化物M的晶胞结构如图所示,则M的
化学式为________,该晶体中氧原子的配位数为________。
(5)下列晶体的堆积方式与E的单质晶体的堆积方式
相同的有________。
①Po ②Zn ③Ag ④K
(6)B可形成两种同素异形体,其中在水中溶解度更大的是________(填化学式),原因是________。
-
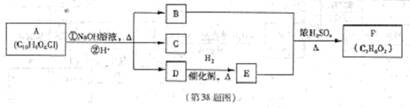
有机物A~F之间的转化关系如下图所示(部分产物已略去),其中B的相对分子质量是D的2倍。
提示: 会自动脱水形成R—CHO
会自动脱水形成R—CHO
根据以上信息回答下列问题:
(1)B的分子式是________
(2)检验D中官能团可使用的试剂名称是________,写出D的相邻同系物与该试剂反应的化学方程式_______________________________。
(3)C遇FeCl3溶液显紫色,核磁共振氢谱中有四个峰,其峰面积比为1:2:2:1。写出C的结构简式_______________________。
(4)写出符合下列条件的C的同分异构体的结构简式_______、______、______、________。
①苯环上存在对位取代基;②遇FeCl3溶液显紫色;
③能与银氨溶液反应。
(5)写出A的结构简式__________________________。
(6)若1molA和足量NaOH反应,最多能消耗___________mol NaOH。





