-
如图为酸雨的形成示意图,相关说法不正确的是
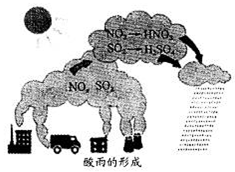
A.HNO3、H2SO4均有腐蚀性
B.酸雨的pH:5.6≤pH≤7
C.汽车尾气中含NO
D.工业尾气中的SO2、NO2的应回收利用
难度: 中等查看答案及解析
-
下列物质中有三种具有某一相同的化学性质,则不属于这三种物质之列的是
A.Na2O2 B.KMnO4 C.HNO3 D.Na2SO4
难度: 简单查看答案及解析
-
下列基团与—OH组成的化合物中,属于饱和醇类的是
A.CH3CH2— B.
C.
D.R—CO—
难度: 简单查看答案及解析
-
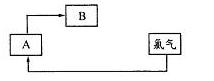
某实验兴趣小组用如图所示装置实验,其中描述不合理的是
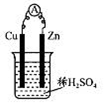
A.Zn为负极
B.H+向负极定向移动
C.化学能转化为电能
D.Cu电极反应:2H++2e-=H2↑
难度: 中等查看答案及解析
-
对下列实验现象的描述不正确的是
A.光亮的金属Na暴露在空气中,表面逐渐变暗
B.将SO2通入品红溶液,品红溶液褪色
C.将Mg(OH)2固体投入FeCl3溶液中,无明显现象
D.浓硫酸与Cu混合加热,可能有白色固体析出
难度: 中等查看答案及解析
-
下列有关说法正确的是
A.含有18个中子的氯原子:
B.
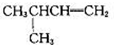 的名称是2—甲基—3—丁烯
的名称是2—甲基—3—丁烯C.化合物
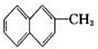 是苯的同系物
是苯的同系物D.乙醇分子中的C—O键可在红外光谱中发生振动吸收
难度: 中等查看答案及解析
-
已知2—氨基丙酸铵结构如图,下列叙述正确的是
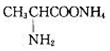
A.该物质中只含有共价键
B.—NH2可以与H2O形成氢键
C.该物质难溶于水
D.该物质的晶体属于分子晶体
难度: 中等查看答案及解析
-
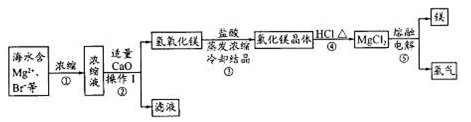
某化学兴趣小组对废铁屑做如图所示的处理。相关分析正确的是
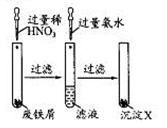
A.滤液的溶质是Fe(NO3)2
B.该实验中发生的反应都为氧化还原反应
C.沉淀X为Fe(OH)2
D.沉淀X受热分解得到Fe2O3
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列叙述正确的是
A.常温下,1L 0.1mol/L的NH4NO3溶液中氮原子数为0.2NA
B.常温常压下,22.4L CH4含有4NA个C—H共价键
C.2mol N2与2mol H2混合充分反应,转移的电子数目为4NA
D.10L pH=1的硫酸溶液中含有的H+离子数为2NA
难度: 中等查看答案及解析
-
下列反应中产生气泡速率最快的是
温度 浓度 催化剂
A 25℃ 2mL5%H2O2 0.1mol/LFeCl32滴
B 35℃ 2mL8%H2O2 MnO2粉末
C 25℃ 2mL5%H2O2 MnO2粉末
D 25℃ 2mL8%H2O2 0.1mol/LCuCl22滴
难度: 中等查看答案及解析
-
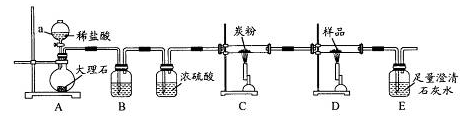
用下列实验装置进行相应实验,能达到实验目的的是
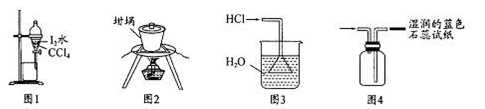
A.用图1所示装置分离有机层和水层
B.用图2所示装置从食盐水中提取NaCl
C.用图3所示装置用水来吸收HCl
D.用图4所示装置收集并检验氨气
难度: 中等查看答案及解析
-
关于柠檬醛的说法不正确的是
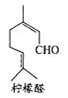
A.该物质存在顺反异构体
B.该物质的分子式为C10H18O
C.该物质可以发生银镜反应
D.1mol该物质最多消耗3molH2
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W在元素周期表中的相对位置如表中所示。下列判断不正确的是
Y
W
X
Z
A.原子半径最大的是X B.电负性最大的是W
C.Y、Z原子序数差为8 D.氢化物最稳定的是Z
难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是
A.将氯气溶于水制备次氯酸:Cl2+H2O
2H++Cl-+ClO-
B.少量CO2通入苯酚钠溶液中:2C6H5O-+CO2+H2O=2C6H5OH+ CO32-
C.Na2O2与H2O混合:2Na2O2+2H2O=4Na++4OH-+O2↑
D.向NH4HCO3溶液中加过量的NaOH溶液并加热:NH4++ OH-
NH3↑+H2O
难度: 困难查看答案及解析
-
下列有机反应属于取代反应的是
A.CH3CH2OH遇炽热CuO B.用新制Cu(OH)2检验葡萄糖
C.戊烷与氯气混合光照 D.苯与足量的氢气反应
难度: 中等查看答案及解析
-
常温,相应条件下,下列各组离子一定能大量共存的是
A.c(Al3+)=0.1mol/L的溶液中:Na+、K+、AlO2-、OH-
B.无色溶液中:K+、CH3COO-、HCO3-、MnO4-
C.
=1×1014的溶液:Ba2+、Na+、SO32-、NO3-
D.通入足量CO2后所含离子还能大量共存的是:K+、Ca2+、NO3-、Cl-
难度: 困难查看答案及解析
-
已知5
+6KMnO4+9H2SO4=3K2SO4+6MnSO4+14H2O+_______。
下列说法不正确的是
A.氧化产物为
B.
作氧化剂
C.每1mol KMnO4转移5mol e- D.H2SO4起酸的作用
难度: 中等查看答案及解析
-
现有室温下两种溶液,有关叙述正确的是
编号
①
②
pH
12
2
溶液
氢氧化钠溶液
醋酸溶液
A.两种溶液中水的电离程度:①=②
B.两种溶液的浓度:c(NaOH)﹥c(CH3COOH)
C.两种溶液等体积混合后:c(CH3COO-)﹥c(Na+)﹥c(OH-)﹥c(H+)
D.加水稀释相同倍数后:c(Na+)﹥c(CH3COO-)
难度: 中等查看答案及解析
-
向某FeBr2溶液中,通入1.12L(标准状况)的Cl2,测得溶液中c(Br-)=3c(Cl-)=0.3mol/L。反应过程中溶液的体积变化不计。则下列说法中正确的是
A.原溶液的浓度为0.1mol/L
B.反应后溶液中c(Fe3+)=0.1mol/L
C.反应后溶液中c(Fe3+)=c(Fe2+)
D.原溶液中c(Br-)=0.4mol/L
难度: 中等查看答案及解析
-
反应I2+I-
I3-达到平衡时c(I3-)与温度的关系如图所示。
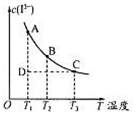
下列说法正确的是
A.图中反应进行到状态D时,一定有v逆>v正
B.A点和B点的化学平衡常数相同
C.对B点溶液升高温度时,该反应△v正>△v逆
D.增大KI溶液浓度有利于I2的溶解
难度: 中等查看答案及解析
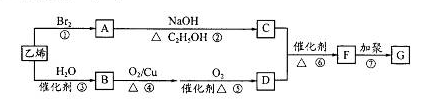
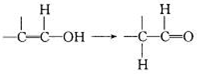 ,则E的结构简式为________。
,则E的结构简式为________。