-
下列变化过程中一定不存在化学能与热能相互转化的是( )
A. 烧制陶瓷 B. 冰融化成水 C. 粮食酿酒 D. 使用火药
难度: 简单查看答案及解析
-
表明金属甲比金属乙活动性强的叙述正确的是( )
A. 在氧化还原反应中,甲失电子数比乙多 B. 甲、乙氢氧化物溶液碱性:甲<乙
C. 甲能与盐酸反应放出H2,而乙不反应 D. 将甲、乙组成原电池时,甲为正极
难度: 中等查看答案及解析
-
反应C(s)+H2O(g)
CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
①增加C的量 ②将容器的体积缩小一半 ③保持体积不变,充入N2使体系压强增大 ④保持压强不变,充入N2使容器体积变大
A. ①③ B. ②③ C. ①④ D. ②④
难度: 中等查看答案及解析
-
实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )
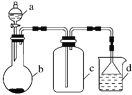
选项
a中的物质
b中的物质
c中收集的气体
d中的物质
A
浓氨水
CaO
NH3
H2O
B
浓硫酸
Na2SO3
SO2
NaOH溶液
C
稀硝酸
Cu
NO2
H2O
D
浓盐酸
MnO2
Cl2
NaOH溶液
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下表为元素周期表中短周期的一部分,其中Y元素的原子序数为M与N元素原子序数之和。下列说法正确的是( )
M
N
X
Y
Z
A. 氢化物的稳定性:N >Z,是因为其氢化物分子间可形成氢键
B. 元素的非金属性:M > Y,是因为元素M形成的化合物种类比元素Y更多
C. 熔沸点:YN2>MN2,是因为YN2的分子间作用力更强
D. 简单离子的半径:N >X,是因为它们具有相同的电子层结构且X的核电荷数更大
难度: 中等查看答案及解析
-
对可逆反应4NH3(g)+5O2(g)
4NO(g)+6H2O(g),下列叙述中正确的是( )
A. 达到化学平衡时,5v正(O2)=4v逆(NO)
B. 若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C. 未达到化学平衡时,正反应速率一定不等于逆反应速率
D. 达到化学平衡时,3v正(NH3)=2v正(H2O)不成立
难度: 中等查看答案及解析
-
一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列叙述正确的是( )
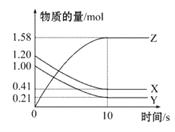
A. 反应开始到10 s,用Z表示的反应速率为0.158 mol·L-1·s-1
B. 10 s后,该反应停止进行
C. 反应的化学方程式为2X(g)+Y(g)
2Z(g)
D. 0~10 s的时间内的平均反应速率:v(X)=v(Y)=0.0395 mol·L-1·s-1
难度: 中等查看答案及解析
-
在一个不传热的固定容积的密闭容器中,可逆反应mA(g)+nB(g)
pC(g)+qD(g),当m、n、p、q为任意整数时,一定达到平衡的标志是( )
①体系的温度不再改变 ②体系的压强不再改变
③各组分的浓度不再改变 ④各组分的质量分数不再改变
⑤反应速率v(A)∶v(B)∶v(C)∶v(D)=m∶n∶p∶q
⑥单位时间内m mol A发生断键反应,同时p mol C也发生断键反应
A. ③④⑤⑥ B. ②③④⑥ C. ①③④⑤ D. ①③④⑥
难度: 中等查看答案及解析
-
某混合气体由一种气态烷烃和一种气态烯烃组成,在同温同压下,混合气体对氢气的相对密度为13,在标准状况下,将56.0L混合气体通入足量溴水,溴水质量增重35.0g,则这两种烃分别是( )
A. CH4 C5H12 B. C2H6 C4H8 C. CH4 C4H8 D. C2H2 C4H10
难度: 中等查看答案及解析
-
等质量的下列烃完全燃烧,消耗氧气最多的是( )
A. C2H4 B. C2H6 C. C3H8 D. C6H6
难度: 简单查看答案及解析
-
由两种气态烃组成的混合物,体积为10ml与过量的氧气混合再充分燃烧,将生成物通过浓H2SO4气体体积减少15ml,再通过碱石灰气体体积又减少20ml [气体体积均为同温(120℃)同压(101kPa)]。混合烃的组成可能为( )
A. C2H6和C2H4 B. C2H4和C2H2 C. CH4和C3H4 D. C4H10和C2H4
难度: 中等查看答案及解析
-
下列化合物的一氯代物有三种的是( )
A. 2,5-二甲基己烷 B. 2,3,4-三甲基戊烷
C. 3,4-二甲基己烷 D. 2,2,3,3-四甲基丁烷
难度: 简单查看答案及解析
-
1mol CH2=CH—CH2CH3与Cl2完全发生加成反应后,再与Cl2彻底取代,两过程共消耗Cl2的物质的量为( )
A. 9mol B. 5mol C. 7mol D. 8mol
难度: 中等查看答案及解析
-
C5H10Cl2分子中含有一个甲基的同分异构体有多少种( )
A. 5 B. 6 C. 7 D. 8
难度: 中等查看答案及解析
-
Al-Ag2O电池是一种可用作水下动力的优良电源,其原理如图所示。该电池工作时总反应式为2Al+3Ag2O+2NaOH=2NaAlO2+6Ag+H2O,则下列说法错误的是 ( )。
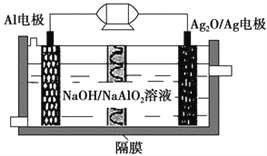
A. 工作时正极发生还原反应,且正极质量逐渐减小
B. 当电极上生成1.08 g Ag时,电路中转移的电子为0.1 mol
C. Al电极的反应式为Al-3e-+4OH-=AlO2-+2H2O
D. 工作时电解液中的Na+移向Ag2O/Ag电极
难度: 中等查看答案及解析
-
某稀溶液中含有4 mol KNO3和2.5 mol H2SO4,向其中加入1.5 mol Fe,充分反应(已知NO
被还原为NO),最终溶液体积为1L。下列说法正确的是( )
A. 反应后生成NO的体积为33.6 L (标况)
B. 所得溶液中c(Fe2+)∶c(Fe3+)=1∶2
C. 所得溶液中c(NO
)=2.75 mol·L-1
D. 所得溶液中的溶质只有FeSO4
难度: 困难查看答案及解析
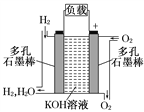
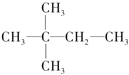 ,对A进行命名,其名称为________。
,对A进行命名,其名称为________。