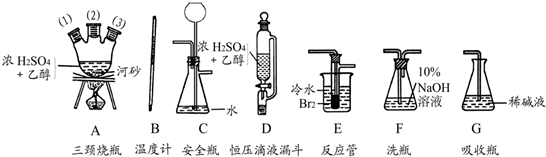
-
类推法在化学学习中经常采用,下列类推的结论正确的是( )
A、由Cl2+2KBr=2KCl+Br2 所以F2也能与KBr溶液反应置换出Br2
B、常温下,由Cu+4HNO3(浓)=Cu(NO3)2+ 2NO2↑+2H2O,所以Fe也能与浓硝酸反应产生NO2
C、由Cu+Cl2
CuCl2 所以Cu+I2
CuI2
D、由钠保存在煤油中,所以钾也可以保存在煤油中。
难度: 中等查看答案及解析
-
下列反应过程中,同时有离子键、极性共价键和非极性共价键的断裂和形成的反应是( )
A、NH4CO3
NH3↑+H2O↑+CO2↑
B、2Na2O2+2H2O =4NaOH+O2↑
C、H2O+Cl2
HCl+HClO
D、NH3+SO2+H2O=NH4HSO3
难度: 中等查看答案及解析
-
下列说法正确的是( )
A、IA族元素的金属性比IIA族元素的金属性强
B、同周期非金属氧化物对应的水化物的酸性从左到右依次增强
C、第三周期元素的离子半径从左到右逐渐减小
D、VIA族元素的氢化物中,稳定性最好的其沸点也最高
难度: 中等查看答案及解析
-
把a mol C2H4跟b mol H2在密闭容器中,在适当条件下,反应达到平衡时生成了p mol C2H6,若将所得平衡混合气体混合气体,生成CO2和H2O,所需氧气的物质的量应是( )
A、(3a+0.5b)mol B、(3a+0.5b)mol
C、(3a+0.5b+3p)mol D、(3a+0.5b-3p)mol
难度: 中等查看答案及解析
-
NA为阿伏加德罗常数,下列有关说法正确的是( )
A、常温下,7.8g固体Na2O2中,含有的阴阳离子总数为0.4NA
B、4℃时,18g2H216O中含有共用电子对数为2NA
C、1mol N5+含有的电子数为34NA
D、用金属铁、Cu片、稀硫酸组成原电池,当金属铁质量减轻5.6g时,流过外电路的电子为0.3NA
难度: 中等查看答案及解析
-
下列化学用语书写正确的是( )
A、 NH4Cl的电子式:
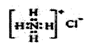
B、HClO的结构式为:H—Cl—O
C、氯化镁的电子式:
D、用电子式表示氯化氢分子的形成过程:
难度: 中等查看答案及解析
-
下列叙述中,金属A的活泼性肯定比金属B的活泼性强的是( )
A、A原子的主族序数比B原子的主族序数大
B、A原子的周期序数B原子的周期序数大
C、1mol A 与酸反应置换出的H2比1 mol B与酸反应置换出的H2多
D、把A、B用导线连接后放入盛有稀硫酸的烧杯中,B上产生气泡
难度: 中等查看答案及解析
-
某单烯烃与氢气的加成产物为:(CH3 )2CHCH2CH3 ,下列相关说法正确的是( )
A、该产物的名称是1,1-二甲基丙烷
B、原单烯烃只可能有3种不同结构
C、1mol加成产物燃烧消耗6.5mol氧气
D、原烯烃与分子式是C3H6的烃一定互为同系物
难度: 中等查看答案及解析
-
室温时,将同种规格的铝片分别投入下列物质混合能放出H2,反应刚开始时化学反应速率最大的是( )
A、0.1mol/L的盐酸15mL B、0.2mol/L的盐酸12mL
C、0.15mol/L的硫酸8mL D、18mol/L的浓硫酸15mL
难度: 中等查看答案及解析
-
在离子 RO3n- 中,共有 x 个核外电子,R 原子的质量数为 A,则 R 原子核内含有的中子数目是( )
A、A-x+n+24 B、A-x-n-24 C、A-x+n+48 D、A+x-n-24
难度: 中等查看答案及解析
-
下列离子方程式或说法正确的是( )
A、向Fe(NO3)2和KI混合溶液中加入少量稀盐酸:3Fe2++4H++NO3-= 3Fe3++ 2H2O+NO↑
B、非金属元素形成的化合物一定是共价化合物
C、SO2通入Ca(ClO)2溶液中:SO2+Ca(ClO)2+H2O=CaSO3↓+2HClO
D、只含有共价键的物质一定是共价化合物
难度: 中等查看答案及解析
-
下列说法中正确的是( )
A、任何化学反应都能设计成原电池
B、原电池两极均发生还原反应
C、原电池中的阳离子向负极移动
D、把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快
难度: 中等查看答案及解析
-
下列试剂中可用于除去CO2中少量SO2杂质的有( )
①饱和NaHCO3溶液;②酸性KMnO4溶液;③溴水;④饱和Na2CO3溶液
A、②③④ B、①③④ C、①②③ D、①②④
难度: 中等查看答案及解析
-
元素周期表和元素周期律可以指导人们进行规律性的推测和判断。下列说法不合理的是( )
A、若X+和Y2-的核外电子层结构相同,则原子序数:X>Y
B、由水溶液的酸性:HCl>H2S,可推断出元素的非金属性:Cl>S
C、硅、锗都位于金属与非金属的交界处,都可以做半导体材料
D、Cs和Ba分别位于第六周期IA和IIA族,碱性:CsOH>Ba(OH)2
难度: 中等查看答案及解析
-
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示:
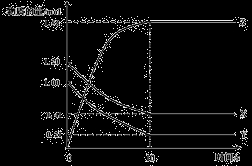
下列描述正确的是( )
A、反应开始到10s,用Z表示的反应速率为0.158 mol·L-1·s-1
B、反应开始到10s,X的物质的量浓度减少了0.79 mol·L-1
C、反应开始到10s,Y的转化率为79.0%
D、反应的化学方程式为:X(g) + Y(g)
Z(g)
难度: 中等查看答案及解析
-
将64g铜与一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状态下的体积为33.6 L。欲使反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要40%的双氧水的质量为( )
A、85g B、79g C、116g D、58g
难度: 困难查看答案及解析