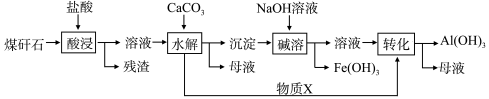
-
下列说法正确的是
A.实验过程中若皮肤不慎沾上少量碱液,应先用大量水冲洗,然后涂上稀硼酸溶液
B.过滤、结晶、焰色反应、灼烧、萃取、分液和蒸馏等都是常用的分离混合物的方法
C.用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小
D.检验淀粉是否发生水解,可在溶液中滴加新制氢氧化铜悬浊液,加热至沸腾,若有红色沉淀生成说明已水解,反之则没有水解
难度: 中等查看答案及解析
-
设NA为阿伏伽德罗常数,下列叙述正确的是
A.23g钠的原子最外层电子数为2NA
B.1L0.1mol·L-1乙酸溶液中H+数为0.1NA
C.标准状况下,22.4L乙烷的分子数为NA
D.1mol甲基所含质子数为10NA
难度: 中等查看答案及解析
-
短周期元素A、B、C、D的原子序数依次增大,原子半径r(C)>r(D)>r(B)>r(A)。B原子最外层电子数是其内层电子总数的3倍,D原子的核电荷数等于A、C原子核电荷数之和,A与C同主族。下列说法正确的是
A.工业上常用电解熔融D的氧化物来制备D的单质
B.单质C、D着火,灭火时C不能用泡沫灭火器,但D可以用泡沫灭火器灭火
C.化合物A2B2与C2B2所含化学键类型完全相同
D.A、B、C组成的化合物,若溶液浓度为0.01mol/L,则常温下其pH为12
难度: 中等查看答案及解析
-
研究人员研制出一种锂水电池,可作为鱼雷和潜艇的储备电源。该电池以金属锂和钢板为电极材料,以LiOH为电解质,使用时加入水即可放电。关于该电池的下列说法不正确的是
A.放电时金属锂作负极 B.放电时OH-向正极移动
C.水既是氧化剂又是溶剂 D.总反应为:2Li+2H2O=2LiOH+H2↑
难度: 中等查看答案及解析
-
下列描述中正确的是
A.ClO3-的空间构型为平面三角形
B.SiF4 和 SO32-的中心原子均为 sp3 杂化
C.在所有的元素中,氟的第一电离能最大
D.C2H5OH 分子中共含有 8 个极性键,1 个 π 键
难度: 中等查看答案及解析
-
下列反应过程中,同时有离子键、极性共价键和非极性共价键的断裂和形成的反应是
A.NH4Cl
NH3↑+ HCl↑ B.NH3+CO2+H2O=NH4HCO3
C.2NaOH+Cl2=NaCl+NaClO+H2O D.2Na2O2+2CO2=2Na2CO3+O2
难度: 中等查看答案及解析
-
晶体硼的结构如右图所示。已知晶体硼结构单元是由硼原子组成的正二十面体,其中有20个等边三角形的面和一定数目的顶点,每个项点上各有1个B原子。下列有关说法不正确的是
A.每个硼分子含有12个硼原子
B.晶体硼是空间网状结构
C.晶体硼中键角是60°
D.每个硼分子含有30个硼硼单键
难度: 中等查看答案及解析
-
若以溴乙烷为主要原料制备乙二酸,则经过的最佳途径反应顺序为
A.取代—消去—加成—氧化 B.消去—加成—取代—氧化
C.消去—取代—加成—氧化 D.取代—加成—氧化—消去
难度: 中等查看答案及解析
-
下列说法正确的是
A.医用酒精是指质量分数为75%的乙醇溶液
B.用过滤的方法可以分离乙醇和乙酸乙酯
C.肥皂能去污的原理,是其在水溶液中能电离出钠离子(亲水基团)和硬脂酸根离子(亲油基团),在它们的共同作用下,通过搓洗,将衣服上的油污“拖下水”
D.葡萄糖、氨基酸在一定条件下都能发生酯化反应
难度: 中等查看答案及解析
-
下列说法正确的是
A.化合物
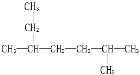 的名称为2-甲基-5-乙基己烷
的名称为2-甲基-5-乙基己烷B.石油催化裂化的主要目的是提高汽油等轻质油的产量
C.在蛋白质溶液中加入硫酸钠溶液和福尔马林,均能使蛋白质变性,失去生理功能
D.CH3COOCH2CH3与CH3CH2CH2COOH互为同分异构体,乙醛和苯甲醛互为同系物
难度: 中等查看答案及解析