-
食盐、蔗糖、醋酸、“84消毒液”、明矾等是灾后居民日常生活中经常使用的物质,下列有关说法或表示正确的是
A.食盐中阴离子的结构示意图为:
B.蔗糖和醋酸都是弱电解质
C.“84消毒液”中有效成分NaClO的电子式为:
D.明矾溶液水解可制得Al(OH)3胶体,用于杀菌消毒
难度: 中等查看答案及解析
-
可以验证硫元素的非金属性比氯元素弱的事实是
①H2S水溶液是弱酸,HCl水溶液是强酸 ②向氢硫酸溶液中滴入氯水有单质硫生成 ③硫、氯气分别与铜和铁反应,其产物是FeS、Cu2S、FeCl3、CuCl2 ④高氯酸(HClO4)的酸性比硫酸强
A.②③④ B.②④ C. ①②④ D.①②③④
难度: 中等查看答案及解析
-
下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是

a b c
A Al AlCl3 Al(OH)3
B HNO3 NO NO2
C S SO3 H2SO4
D Si SiO2 H2SiO3
难度: 中等查看答案及解析
-
下列反应的离子方程式书写正确的是
A.向NH4HSO4稀溶液中逐滴加入Ba(OH)2稀溶液至刚好沉淀完全:Ba2+ + 2OH- + NH4+ + H+ + SO42- = BaSO4↓+ NH3·H2O + H2O
B.碳酸钙溶于醋酸:CaCO3 + 2H+ =Ca2+ + CO2↑+ H2O
C.向硅酸钠溶液中通入过量的CO2:SiO32-+ CO2 + H2O= H2SiO3↓+ CO32-
D.澄清石灰水与过量小苏打溶液混合:Ca2+ + OH- + HCO3-== CaCO3↓+H2O
难度: 困难查看答案及解析
-
下列关于氯水的叙述,不正确的是
A.新制氯水中只含有Cl2和H2O分子
B.加入AgNO3溶液有白色沉淀产生
C.光照氯水有气泡逸出,久置的氯水,酸性增强
D.饱和氯水与石灰石的反应是制取较浓HClO溶液的重要方法
难度: 中等查看答案及解析
-
下列说法正确的是
A.HF、HCl、HBr、HI的热稳定性依次减弱,沸点却依次升高
B.熔融状态下能导电的化合物一定含离子键;金属与非金属元素形成的化合物一定是离子化合物
C. NCl3分子中所有的原子均为8电子稳定结构
D.NaHSO4晶体中阴、阳离子的个数是1:2且熔化时破坏的是离子键和共价键
难度: 中等查看答案及解析
-
设NA为阿伏伽德罗常数的数值,下列说法正确的是
A.常温下,23g NO2含有NA个氧原子
B.标准状况下,11.2L SO3中含有的分子数为0.5NA
C.1 mol Cl2做氧化剂转移的电子数是NA
D.1L 0.1mol•L-1的氨水中含OH―离子数为0.1NA个
难度: 中等查看答案及解析
-
已知2SO2 (g) + O2 (g)
2SO3 (g);ΔH =-197 kJ·mol-1。向同温、同体积的三个密闭容器中分别充入气体:(甲) 2 mol SO2和1 mol O2;(乙) 1 mol SO2和0.5 mol O2 ;(丙) 2 mol SO3 。恒温、恒容下反应达平衡时,下列关系一定正确的是
A.容器内压强P:P甲=P丙 > 2P乙
B.SO3的质量m:m甲=m丙 > 2m乙
C.c(SO2)与c(O2)之比k:k甲=k丙 > k乙
D.反应放出或吸收热量的数值Q:Q甲=Q丙 > 2Q乙
难度: 困难查看答案及解析
-
下列各组离子在指定条件下,一定能大量共存的是
A.pH为1的无色溶液:K+、Fe2+、SO32-、Cl-
B.能使碘化钾淀粉试纸变蓝的溶液:Na+、NH4+、S2-、Br-
C.水电离出的c(H+)=10-12mol/L的溶液:Ba2+、Na+、NO3-、Cl-
D.加入铝条有氢气放出的溶液:Na+、NH4+、HCO3-、SO42-
难度: 中等查看答案及解析
-
①在含有FeCl3和BaCl2的酸性混合液中,通入足量SO2气体,有白色沉淀生成,过滤后,向滤液中滴加KSCN溶液,不出现红色,②在氨水和BaCl2的混合液中,通入适量SO2气体,也有白色沉淀生成,由此得出的结论是
A.白色沉淀都是BaSO3
B.①白色沉淀是BaSO3 和S,②是BaSO3
C.①白色沉淀是BaSO4,②是BaSO3
D.①白色沉淀是FeSO3,②是BaSO3
难度: 中等查看答案及解析
-
已知A、B、C均为短周期的元素,A、B同周期,A、C的最低价离子分别为A2- 和C—,B2+和C—具有相同的电子层结构,下列说法正确的是
A.离子半径:A2->C—>B2+ B.C元素的最高正价一定为+7价
C.对应气态氢化物的稳定性A>C D.还原性:A2-<C-
难度: 困难查看答案及解析
-
CuSO4是一种重要的化工原料,其有关制备途径如图所示。下列说法不正确的是
(已知:2Cu
O2
2H2SO4=2CuSO4
2H2O)
A.相对于途径①、③,途径②更好地体现了绿色化学思想
B.途径③中,1mol Cu与足量浓硫酸反应会产生64g SO2气体
C.途径①所用混酸中H2SO4与HNO3物质的量之比最好为
D.1mol Cu分别按照途径②、③中,被还原的H2SO4的质量之比为
难度: 中等查看答案及解析
-
已知:H2(g) +I2(g)
2HI(g) ΔH = -14.9 kJ/mol。在甲、乙两个体积相同密闭容器中充入反应物,保持恒温恒容,其起始浓度如下表所示。甲中反应达到平衡时,测得c(H2)=0.008 mol/L。 下列判断正确的
起始浓度
c(H2) / mol/L
c(I2) / mol/L
c(HI) / mol/L
甲
0.01
0.01
0
乙
0.02
0.02
0
A.平衡时,乙中H2的转化率是甲中的2倍
B.平衡时,甲中混合物的颜色比乙中深
C.平衡时,甲、乙中热量的变化值相等
D.该温度下,反应的平衡常数K=0.25
难度: 困难查看答案及解析
-
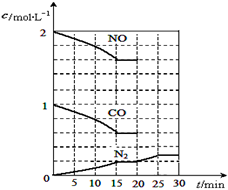
已知某反应aA(g) +bB(g)
cC(g) ΔH =Q 在密闭容器中进行,在不同温度(T1 和T2 )及压强(P1 和P2 )下,混合气体中B的质量分数w(B)与反应时间(t)的关系如图所示,下列判断正确的是
A.T1<T2, P1<P2 ,a+b>c ,Q>0
B.T1>T2 ,P1<P2 ,a+b<c ,Q<0
C.T1<T2 ,P1>P2 ,a+b<c, Q>0
D. T1<T2 ,P1>P2 ,a+b>c ,Q<0
难度: 困难查看答案及解析
-
1 L某混合溶液中,溶质X、Y浓度都为0.1mol·L—1,向混合溶液中滴加0.1 mol·L—1某溶液Z,所得沉淀的物质的量如图所示,则X、Y、Z分别是

A.氯化铝、氯化镁、氢氧化钠
B.偏铝酸钠、氢氧化钡、硫酸
C.氯化铝、氯化铁、氢氧化钠
D.偏铝酸钠、氯化钡、硫酸
难度: 中等查看答案及解析
-
如下图所示,其中甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O

下列说法正确的是
A.甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置
B.甲池通入CH3OH的电极反应为CH3OH-6e-+2H2O=CO32-+8H+
C.甲池中消耗280 mL(标准状况下)O2,此时丙池中理论上最多产生1.45g固体
D.反应一段时间后,向乙池中加入一定量Cu(OH)2固体,能使CuSO4溶液恢复到原浓度
难度: 中等查看答案及解析
-
用4种溶液进行实验,下表中“操作及现象”与“溶液”不符的是
选项 操作及现象 溶液
A 通入SO2,溶液不变浑浊,再加氯水,变浑浊 BaCl2溶液
B 通入CO2,溶液变浑浊,再加入品红溶液,红色褪去 Ca(ClO)2溶液
C 通入SO2,溶液变浑浊,继续通SO2至过量,浑浊消失,再加入足量NaOH溶液,又变浑浊 Ca(OH)2溶液
D 通入NH4HCO3受热分解产生的气体,溶液变浑浊,继续通入该气体,浑浊消失 Ca(OH)2溶液
难度: 困难查看答案及解析
-
下列叙述正确的是
A.合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率
B.含1 mol Ba(OH)2的稀溶液和含1 mol H2SO4的稀溶液反应释放热量akJ,则表示该反应中和热的热化学反应方程式为:
OH-(aq)+H+(aq)=H2O(l) ∆H = -a kJ·mol-1
C.电解精炼铜时,同一时间内阳极溶解铜的质量比阴极析出铜的质量小
D.对于2HI(g)
H2(g)+I2(g)平衡体系,增大平衡体系的压强可使颜色变深,符合勒夏特列原理解释。
难度: 中等查看答案及解析