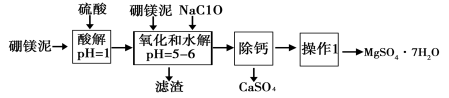
-
化学与生产、生活密切相关。下列说法正确的是
A.对“地沟油”进行分馏可以获得汽油发动机的燃料
B.用纯碱制玻璃、用铁矿石炼铁都会产生温室气体
C.海水中有大量人类需要的物质,可以大量开发海水中的物质,以解决资源短缺的问题
D.工业上以氯气和澄清石灰水为原料制造漂白粉
难度: 中等查看答案及解析
-
下列推断正确的是
A.绿色化学的核心是应用化学原理对环境污染进行治理
B.硅是地壳中含量位居第二的元素,玛瑙、光导纤维的主要成分为SiO2
C.配制240 mL 1 mol·L-1的NaOH溶液需称NaOH固体的质量为9.6 g
D.要除去衣服上的顽固污渍,均可将衣服泡在漂白液中
难度: 中等查看答案及解析
-
下列有关试剂的保存方法,错误的是
A.浓硝酸保存在无色玻璃试剂瓶中
B.少量的钠保存在煤油中
C.氢氧化钠溶液保存在具橡皮塞的玻璃试剂瓶中
D.新制的氯水通常保存在棕色玻璃试剂瓶中
难度: 简单查看答案及解析
-
下列与金属腐蚀有关的说法,正确的是
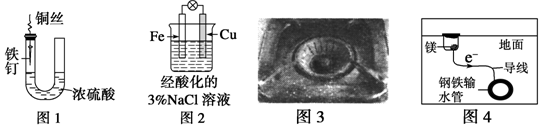
A.图1中,铁钉易被腐蚀
B.图2中,滴加少量KSCN溶液,溶液变为血红色
C.图3中,燃气灶的中心部位容易生锈,主要是由于高温下铁发生化学腐蚀
D.图4中, 用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块相当于原电池的正极
难度: 中等查看答案及解析
-
下列指定粒子的个数比一定为2︰1的是
A.Be2+中的电子和质子 B.
中的中子和质子
C.Na2CO3溶液中的Na+和CO32- D.Na2O2固体中的阳离子和阴离子
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的数值,下列说法正确的是
A.1 mol Na2O2与水完全反应时转移电子数为2NA
B.由2H和18O组成的水11 g,所含的中子数为5NA
C.14 g乙烯、丙烯的混合气体,含有C—H键数为2NA
D.50 mL 18 mol·L-1浓硫酸与足量铜反应,转移的电子数为1.8NA
难度: 中等查看答案及解析
-
下列物质转化在给定条件下不能实现的是
①SiO2
Na2SiO3
H2SiO3
②S
SO3
H2SO4
③饱和NaCl(aq)
NaHCO3
Na2CO3
④Fe2O3
FeCl3(aq)
无水FeCl3
⑤MgO
MgCl2溶液
Mg
A.①③⑤ B.②③④ C.②④⑤ D.①④⑤
难度: 简单查看答案及解析
-
研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2—CaO作电解质,利用下图所示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛。下列说法中,正确的是

A.由TiO2制得1 mol金属Ti,理论上外电路转移2 mol电子
B.阳极的电极反应式为C+2O2--4e-===CO2↑
C.在制备金属钛前后,整套装置中CaO的总量减少
D.若用铅蓄电池作该装置的供电电源,“+”接线柱应连接Pb电极
难度: 中等查看答案及解析
-
在下述条件下,一定能大量共存的离子组是
A.无色透明的水溶液中:K+、Ba2+、Cl-、MnO4-
B.含有大量NO3-的水溶液中:NH4+、Fe2+、SO42-、H+
C.滴入酚酞试剂显红色的溶液中:Na+、K+、CO32-、Br-
D.强碱性溶液中:ClO-、S2-、HSO3-、Na+
难度: 中等查看答案及解析
-
短周期元素W、X、Y、Z的原子序数依次增大,W、X的最外层电子数之比为4︰3,Y原子的最外层电子数是次外层电子数的一半,Z元素原子的半径在同周期元素原子中最小。下列叙述正确的是
A.W、X、Y的最高价氧化物都能与NaOH溶液反应,它们都属于酸性氧化物
B.W、Y、Z三种元素简单气态氢化物的热稳定性为: Z>W>Y
C.Z元素最高价氧化物对应的水化物的化学式为HZO3
D.原子半径的大小顺序为:rY>rW>rX
难度: 中等查看答案及解析
-
常温下,有关醋酸溶液的叙述中正确的是
A.用pH 计测得0.1 mol·L-1的CH3COOH溶液的 pH约2.9,说明CH3COOH是弱酸
B.将pH=3的醋酸稀释为pH=4的过程中,
比值不变
C.向0.1 mol·L-1的CH3COOH溶液中加入少量CH3COONa固体,CH3COOH和H2O的电离程度都减小
D.pH=3的醋酸和盐酸分别与pH=11的NaOH溶液完全中和,两者消耗NaOH溶液的体积相同
难度: 中等查看答案及解析
-
火法炼铜首先要焙烧黄铜矿,反应为:2CuFeS2+O2=Cu2S+2FeS+SO2 则下列说法正确的是
A.CuFeS2仅作还原剂,硫元素被氧化
B.每生成1mol Cu2S,有4 mol硫被氧化
C.SO2只是氧化产物,FeS只是还原产物
D.每转移1.2 mol电子,有0.2mol硫被氧化
难度: 中等查看答案及解析
-
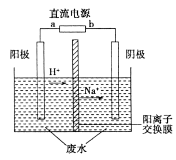
某种聚合物锂离子电池放电时的反应为:Li1-xCoO2+LixC6===6C+LiCoO2,其电池如图所示。

下列说法不正确的是
A.放电时,LixC6发生氧化反应
B.充电时,Li+通过阳离子交换膜从左向右移动
C.充电时将电池的负极与外接电源的负极相连
D.放电时,电池的正极反应为Li1-xCoO2+xLi++xe-===LiCoO2
难度: 中等查看答案及解析
-
对于可逆反应N2(g)+3H2(g)
2NH3(g) △H<0,下列研究目的和示意图相符的是
A
B
C
D
研究
目的
压强对反应的影响(P2>P1)
温度对反应的影响
平衡体系增加N2对反应的影响
催化剂对反应的影响
图示




难度: 中等查看答案及解析
-
在标准状况下,将a L NH3完全溶于水得到V mL氨水,溶液的密度为ρg·cm-3,溶质的质量分数为w,溶质的物质的量浓度为c mol·L-1。下列叙述中正确的是
①
②
③若上述溶液中再加入V mL水后,所得溶液的质量分数大于0.5w
④将50g上述溶液加入一定量的水稀释成0.5 c mol·L-1,则加入水的体积应大于50mL
A.①④ B.②③ C.①③ D.②④
难度: 困难查看答案及解析