-
下列离子方程式的书写正确的是( )
A.氢氧化铁溶于氢碘酸中:Fe(OH)3 + 3H+ = Fe3+ + 3H2O
B.向0.1L 5mol/L亚硫酸氢铵溶液中逐滴加入0.1L 7 mol·L-1 NaOH溶液:
2NH4++5HSO3-+7OH-=2NH3·H2O+5SO32-+5H2O
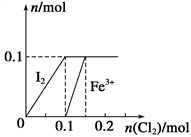
C.FeI2溶液中通入过量Cl2:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-
D.从酸化的海带灰浸出液中提取碘:2I-+H2O2=I2+2OH-
难度: 中等查看答案及解析
-
下列说法正确的是 ( )
A. 石油裂解、煤的气化、海水制镁、纤维素制火棉等过程中都包含化学变化
B. 红宝石、水晶、玻璃、陶瓷等都是硅酸盐制品
C. 光导纤维、醋酸纤维、铜氨纤维、玻璃纤维等的主要成分都是糖类
D. PM2.5是指大气中直径小于或等于2.5纳米的颗粒物
难度: 简单查看答案及解析
-
血糖浓度(血液中葡萄糖的含量)是人体的重要生理指标,其值常以两种计量单位表示,即mmol/L和mg/dL(1 L=10 dL)。以mmol/L表示时,人的血糖值在3.61~6.11 mmol/L之间为正常,下列血糖浓度属于正常值的是 ( )
A. 2.88 mmol/L B. 0.008 mol/L C. 95 mg/dL D. 52 mg/dL
难度: 简单查看答案及解析
-
不用其它试剂,用最简单的方法鉴别下列物质:①NaOH溶液,②Mg(NO3)2溶液,③CuSO4溶液,④KCl溶液,正确的鉴别顺序是( )
A.①②③④ B.③④②① C.④①②③ D.③①②④
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述正确的是
A.标准状态下,33.6L氟化氢中含有氟原子的数目为1.5NA
B.常温常压下,7.0g乙烯与丙烯的混合物中含有氢原子的数目为NA
C.50mL18.4mol·L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA。
D.某密闭容器盛有0.1molN2和0.3molH2,在一定条件下充分反应,转移电子的数目为0.6NA
难度: 中等查看答案及解析
-
将0.195 g锌粉加入到200 mL的0.100 mol·L-1 MO2+ 溶液中,恰好完全反应,则还原产物可能是 ( )
A.M B.M2+ C.M3+ D.MO2+
难度: 困难查看答案及解析
-
A. 转移溶液后未洗涤烧杯和玻璃棒就直接定容
B. 在容量瓶中进行定容时仰视刻度线
C. 在容量瓶中定容时俯视刻度线
D. 定容后把容量瓶倒转摇匀,发现液面低于刻度,再补充几滴水至刻度
难度: 中等查看答案及解析
-
将标准状况下的
LHCl(g)溶于1000g水中,得到的盐酸密度为bg·/mL,则该盐酸的物质的量浓度是
A.
mo1·L-1 B.
mol·L-1
C.
mol·L-1 D.
mol·L-1
难度: 中等查看答案及解析
-
某10% NaOH溶液,加热蒸发掉100 g水后得到80 mL 20%的溶液,则该20% NaOH溶液的物质的量浓度为( )
A.6.25 mol /L B.12.5 mol /L C.7 mol /L D.7.5 mol /L
难度: 简单查看答案及解析
-
氧化铁和氧化铜混合物mg,加3mol·L-1盐酸溶液100mL,恰好完全溶解,若mg的该混合物在过量氢气流中加热充分反应,冷却后剩余固体质量为( )
A.(m-2.4)g B.(m-1.6) g C.(m-3.2)g D. 无法确定
难度: 中等查看答案及解析
-
某硫酸镁和硫酸铝的混合溶液中,c(Mg2+ )=2 mol·L-1,c(SO42-)=6.5 mol·L-1,若将200 mL此混合液中的Mg2+和Al3+分离,至少应加入1.6 mol·L-1氢氧化钠溶液的体积是
A.0.5 L B.1.625 L C.1.8 L D.2 L
难度: 中等查看答案及解析
-
已知有如下反应:①2BrO3-+Cl2==Br2+2ClO3-,②ClO3-+5Cl-+6H+==3Cl2+3H2O,
③2FeCl3+2KI==2FeCl2+2KCl+I2,④2FeCl2+Cl2==2FeCl3。
下列各微粒氧化能力由强到弱的顺序正确的是 ( )
A. ClO3->BrO3->Cl2>Fe3+>I2 B. BrO3->Cl2>ClO3->I2>Fe3+
C. BrO3->ClO3->Cl2>Fe3+>I2 D. BrO3->ClO3->Fe3+>Cl2>I2
难度: 简单查看答案及解析
-
(NH4)2SO4在高温下分解,产物是SO2、H2O、N2和NH3。在该反应的化学方程式中,化学计量数由小到大的产物分子依次是
A.SO2、H2O、N2、NH3 B. H2O、SO2、N2、NH3
C.N2、SO2、NH3、H2O D.H2O 、NH3、SO2、N2
难度: 中等查看答案及解析
-
已知在热的碱性溶液中,NaClO发生如下反应:3NaClO
2NaCl+NaClO3。在相同条件下NaClO2也能发生类似的反应,其最终产物是
A.NaCl、NaClO
B.NaCl、NaClO3
C.NaClO、NaClO3
D.NaClO3、NaClO4
难度: 中等查看答案及解析
-
固体单质A和气体单质B在容积一定的密闭容器中完全反应生成气体C,同温下测得容器内压强不变,且反应后气体C的密度是原气体密度的4倍。则下列判断正确的是
A.生成的气体C为单质,且B和C的摩尔质量比为1∶4
B.生成物C中A的质量分数为75%
C.生成物C中A、B的原子个数比为3∶1
D.反应前后气体分子数比为1∶4
难度: 中等查看答案及解析
-
一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体V L(标准状况),向反应后的溶液中(存在Cu2+和SO42-)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO 12.0g,若上述气体为NO和NO2的混合物,且体积比为1:1,则V可能为( )
A.9.0 L B.13.5 L C.15.7 L D.16.8 L
难度: 困难查看答案及解析
-
含有a mol FeBr2的溶液中,通入x mol Cl2。下列各项为通Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是( )
A.x=0.4a,2Fe2++Cl2=2Fe3++2Cl-
B.x=0.6a,2Br-+ Cl2=Br2+2Cl-
C.x=a,2Fe2++2Br-+2Cl2=Br2+2Fe3++4Cl-
D.x=1.5a,2Fe2++4Br-+3Cl2=2Br2+2Fe3++6Cl-
难度: 中等查看答案及解析
-
在下列各溶液中,离子一定能大量共存的是( )
A. 室温下,pH=1的溶液中:Na+、Fe3+、NO
、SO
B. 含有0.1 mol·L-1 Fe3+的溶液中:K+、Mg2+、I-、NO
C. 加入铝粉有气泡产生的溶液中:Na+、NH
、Fe2+、NO
D. 在AlCl3溶液中:K+、Na+、SiO
、SO
难度: 简单查看答案及解析
-
向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如下图所示。则下列离子组在对应的溶液中,一定能大量共存的是( )
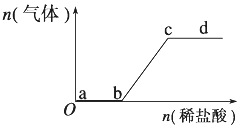
A. a点对应的溶液中:Na+、OH-、SO
、N
O
B. b点对应的溶液中:Al3+、Fe3+、MnO
、Cl-
C. c点对应的溶液中:Na+、Ca2+、NO
、Cl-
D. d点对应的溶液中:F-、NO
、Fe3+、Ag+
难度: 中等查看答案及解析
-
某无色溶液中可能含有I-、NH4+、Cu2+、SO32-,向该溶液中加入少量溴水,溶液呈无色,则下列关于溶液组成的判断正确的是( )。
①肯定不含I-;②肯定不含Cu2+;③肯定含有SO32-;④可能含有I-
A.①③ B.①②③ C.①③④ D.②③④
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列叙述正确的是 ( )
A. 5.4 g H2O分子中的氢原子数为0.3NA
B. 25℃,1 L pH=12的氨水中,含有OH-的数目为0.1NA
C. 标准状况下,32 g硫(结构如图所示)含S—S键的数目为NA
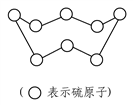
D. 在反应KIO3+6HI===3I2+KI+3H2O中,每生成1 mol I2转移电子数为2NA
难度: 中等查看答案及解析
-
下列各组离子或分子在溶液中能大量共存,且满足相应要求的是 ( )
选项
离子或分子
要求
A
K+、NO
、Cl-、HS-
c(K+)<c(Cl-)
B
Fe3+、NO
、SO
、Cl-
逐滴滴加盐酸立即有气体产生
C
Na+、HCO
、Mg2+、SO
逐滴滴加氨水立即有沉淀产生
D
NH
、Al3+、SO
、CH3COOH
滴加NaOH浓溶液立刻有气体产生
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
MnO2的一些性质或用途如图,下列说法正确的是( )
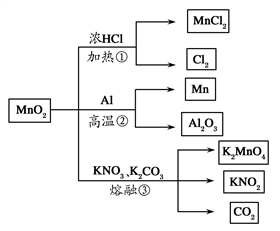
A. ①、②、③三个反应中MnO2均作氧化剂
B. 足量MnO2与2 L 10 mol/L HCl共热,可生成5 mol Cl2
C. 反应②若生成1 mol Al2O3,则反应过程中转移12 mol电子
D. 反应③中K2CO3和KNO3的化学计量数均为1
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是( )
A. 向明矾溶液中加入过量的氢氧化钡溶液:
B. 向氢氧化亚铁中加入足量的稀硝酸:
C. 向磷酸二氢铵溶液中加入足量的氢氧化钠溶液:
D. 向
中加入足量的氢氧化钠溶液并加热:
难度: 中等查看答案及解析
-
一定量的铜和浓硫酸在加热条件下充分反应,向反应后的溶液中逐滴加入含a mol NaOH的溶液,恰好使反应后的溶液呈中性,则下列叙述错误的是( )
A.溶液中c(Na+)=2c(SO42-)
B.
mol>沉淀的物质的量>0
C.沉淀的物质的量=
mol
D.原浓硫酸中H2SO4的物质的量>
mol
难度: 中等查看答案及解析