-
化学与生产、生活密切相关,下列说法不正确的是
A. 用活性炭为糖浆脱色和用次氯酸盐漂泊纸浆的原理不相同
B. “以火烧之,紫青烟起,乃真硝石(KNO3)”,“紫青烟”是因为发生了焰色反应
C. 工业上燃烧煤时,加入少量石灰石是为了减少SO2的排放
D. 硅胶具有较强的还原性,可以用作袋装食品的抗氧化剂
难度: 简单查看答案及解析
-
阿伏加德罗常数的值为NA,下列有关叙述不正确的是
A. 标准状况下,11.2LHF中含有氟原子的数目为0.5 NA
B. 含1molCl-的NH4Cl溶液中加入适量氨水使溶液呈中性,此时溶液中NH4+数为NA
C. 13g锌与一定量浓硫酸恰好完全反应,生成气体的分子数为0.2 NA
D. 28g乙烯和环丁烷的混合气体中含有的碳原子数为2 NA
难度: 简单查看答案及解析
-
有机物W 在工业上常用作溶剂和香料,其合成方法如下:
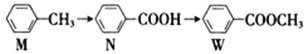
下列说法正确的是
A. N、W 组成上相差一个CH2原子团,所以互为同系物
B. M、N、W 均能发生加成反应、取代反应
C. W 属于酯类,能发生皂化反应
D. M 的二氯代物有8种
难度: 中等查看答案及解析
-
下列实验操作及现象,能推出相应结论的是
选项
实验操作及现象
结论
A
常温下,用pH计测得0.1mol·L-1NaClO溶液和0.1mol·L-1CH3COONa溶液的pH,前者大
酸性:CH3COOH>HClO
B
向淀粉溶液中加入稀硫酸并加热,再加入银氨溶液,水浴加热,未见有银镜产生
淀粉没有水解
C
向MgCl2溶液中滴加足量NaOH溶液,有白色沉淀生成;再滴加CuCl2溶液,有蓝色沉淀生成
Ksp[Cu(OH)2]<Ksp[Mg(OH)2]
D
向Fe(NO3)2样品,溶于稀硫酸,滴加KSCN溶液,溶液变红
Fe(NO3)2样品溶于稀硫酸前已氧化变质
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
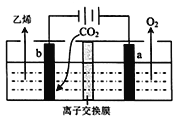
十九大报告中提出要“打赢蓝天保卫战”,意味着对大气污染防治比过去要求更高。二氧化硫—空气质子交换膜燃料电池实现了制硫酸、发电、环保三位一体的结合,原理如图所示。下列说法正确的是
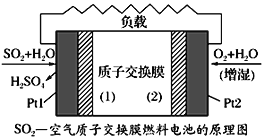
A. 该电池放电时质子从Pt2电极经过内电路流到Pt1电极
B. Pt1电极附近发生的反应为:SO2+2H2O-2e-=H2SO4+2H+
C. Pt2电极附近发生的反应为O2+4e-+2H2O=4OH-
D. 相同条件下,放电过程中消耗的SO2和O2的体积比为2∶1
难度: 中等查看答案及解析
-
已知短周期主族元素X、Y、Z、W、R,其中X的原子半径在短周期主族元素中最大,Y元素的原子最外层电子数为m,次外层电子数为n,Z元素的原子L层电子数为m+n,M层电子数为m-n,W与Z同主族,R元素原子与Y元素原子的核外电子数之比为2:1。下列叙述错误的是
A. X与Y形成的两种化合物中阴、阳离子的个数比均为1:2
B. Y的氢化物比R的氢化物稳定,且熔沸点高
C. RY2和WY2通入Ba(NO3)2溶液中均不产生白色沉淀
D. RY2和X2Y2均具有漂白性,均能使品红试液褪色
难度: 中等查看答案及解析
-
常温下,Ka1(H2C2O4)=10-1.3, Ka2(H2C2O4)=10-4.2。用0.1000 mol·L-1 NaOH溶液滴定10.00 mL 0.1000 mol·L-1 H2C2O4溶液所得滴定曲线如图。下列说法正确的是
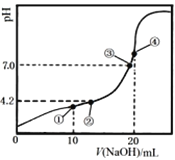
A. 点①所示溶液中:c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
B. 点②所示溶液中:c(HC2O4-)=c(C2O42-)
C. 点③所示溶液中:c(Na+)=c(HC2O4-) + c(C2O42-)
D. 点④所示溶液中:c(Na+) + c(H2C2O4) + 2c(H+)=2c(OH-) + 2c(C2O42-)
难度: 困难查看答案及解析
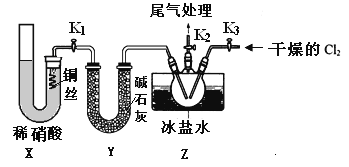
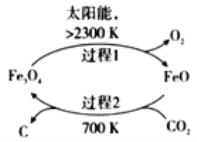
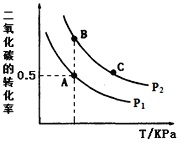
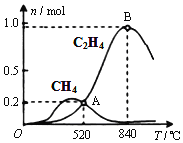
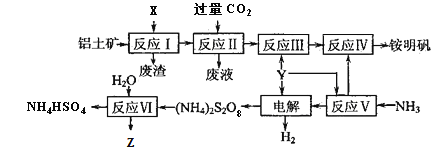


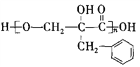 )为一种高分子树脂,其合成路线如下:
)为一种高分子树脂,其合成路线如下: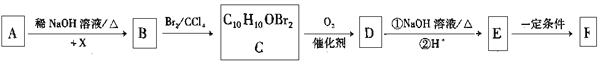
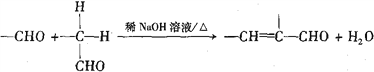
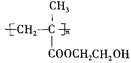 )的合成路线(无机试剂自选):_________________。
)的合成路线(无机试剂自选):_________________。