-
据报道,我国拥有完全自主产权的氢氧燃料电池车已提供服务,某种氢氧燃料电池的电解液为KOH溶液。下列有关该电池的叙述不正确的是( )
A.正极反应式为:O2+2H2O+4e-==4OH-
B.工作一段时间后,电解液中KOH的物质的量不变
C.该燃料电池的总反应方程式为:2H2+O2 = 2H2O
D.该电池工作时每消耗1 mol O2,有2 mol电子转移
难度: 中等查看答案及解析
-
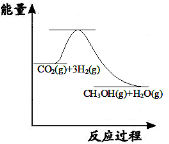
在200℃下,S8(s)和O2(g)发生反应依次转化为SO2(g)和SO3(g)。反应过程和能量关系可用下图简单表示(图中的ΔH表示生成1 mol含硫产物的数据)。由图得出的结论正确的是( )

A.S8(s)的燃烧热ΔH=-8a kJ·mol-1
B.2SO3(g)===2SO2(g)+O2(g) ΔH=-2b kJ·mol-1
C.S8(s)+8O2(g)===8SO2(g) ΔH=-a kJ·mol-1
D.由1 mol S8(s)生成SO2的反应热ΔH=-(a+b) kJ·mol-1
难度: 中等查看答案及解析
-
已知3.6g碳在6.4g氧气中燃烧,至反应物耗尽,并放出X kJ热量。已知单质碳的燃烧热为YkJ/mol,则1mol C与O2反应生成CO的反应热ΔH为( )
A.-Y kJ/mol B.—(5X—0.5Y)kJ/mol
C.—(10X—Y)kJ/mol D.+(10X—Y)kJ/mol
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.流水、风力是一次能源,电力、蒸汽是二次能源
B.普通锌锰电池是一次电池,碱性锌锰电池是二次电池
C.铅蓄电池是一次电池,氢氧燃料电池是二次电池
D.同周期元素形成的简单离子中,原子序数越大的离子半径越小
难度: 简单查看答案及解析
-
下列关于化学用语的表示正确的是( )
A.质子数为17、中子数为20的氯(Cl)原子:
B.CO2的电子式:
C.镁离子的结构示意图:
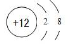
D.CCl4分子的比例模型:
难度: 简单查看答案及解析
-
某鱼雷采用Al-Ag2O动力电池,以溶解有氢氧化钾的流动海水为电解液,电池反应为:2Al+3Ag2O+2KOH=6Ag+2KAlO2+H2O,下列说法不正确的是 ( )
A.Ag2O为电池的正极 B.Al在电池反应中被氧化
C.电子由Ag2O极经外电路流向Al极 D.溶液中的OH-向Al极迁移
难度: 困难查看答案及解析
-
四种离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是( )
A.W、Y的原子序数a>c B.离子的还原性Y2-<Z-
C.原子最外层电子数Y<W D.离子半径X+>Z-
难度: 中等查看答案及解析
-
Fe2O3(s)+
C(s) ===
CO2(g)+2Fe(s) ΔH1=+234.1 kJ/mol;C(s)+O2(g) === CO2(g) ΔH2=-393.5 kJ/mol;则2Fe(s)+
O2(g) === Fe2O3(s)的ΔH是( )
A.-627.6 kJ/mol B.-824.4 kJ/mol
C.-744.7 kJ/mol D.-169.4 kJ/mol
难度: 中等查看答案及解析
-
已知H2(g)+Br2(g)=2HBr(g) ΔH= A KJ/mol,其他的相关数据如下表:
H2(g)
Br2(g)
HBr(g)
1mol分子中的化学键断裂时需要吸收的能量/kJ
B
X
C
则表中X为( )
A.A-B+C B.2C-A-B C.C-A-B D.A-B+2C
难度: 中等查看答案及解析
-
以下互为同位素的是( )
A.13C与14N B.D2与H2 C.O2与O3 D.35Cl与37Cl
难度: 简单查看答案及解析
-
W、X、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Z是非金属元素,W、X的最高价氧化物对应的水化物可以相互反应生成盐和水,向一定量的W的最高价氧化物对应的水化物溶液中逐滴加入XZ3溶液,生成的沉淀X(OH)3的质量随XZ3溶液加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是( )

A.d点对应的溶液中:K+、NH4+、CO32﹣、I﹣
B.c点对应的溶液中:Ag+、Ca2+、NO3﹣、Na+
C.b点对应的溶液中:Na+、S2﹣、SO42﹣、Cl﹣
D.a点对应的溶液中:Na+、K+、S042﹣、HCO3﹣
难度: 中等查看答案及解析
-
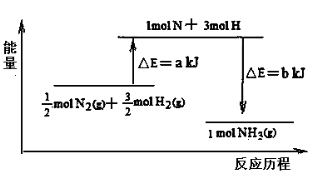
.碘与氢气反应的热化学方程式是
①I2(g) + H2(g)
2HI(g) ΔH=-9.48 kJ·mol-1
②I2(s) + H2(g)
2HI(g) ΔH= +26.48 kJ·mol-1
下列说法正确的是( )
A.②的反应物总能量比①的反应物总能量低
B.I2(s) = I2(g) ΔH= +17.00 kJ·mol-1
C.①的产物比②的产物稳定
D.1mol I2(g)中通入1 mol H2(g),发生反应时放热9.48 kJ
难度: 中等查看答案及解析
-
短周期原子序数依次增大的主族元素R、T、Q、W、Y具有如下信息:① R、Y原子的最外层电子数与电子层数相同;② Q是地壳中含量最高的元素,R与T的核电荷数之和等于Q的核电荷数;③ W与R同主族。下列说法正确的是( )
A.元素Q与W形成的两种常见化合物中含有相同比例的阴、阳离子
B.元素T、Q、W、Y的原子半径大小为:T<Q<Y<W
C.Q与Y组成的常见物质是一种两性物质,结构中含有共价键
D.由Y和T组成的物质YT,在电子和陶瓷工业上有广泛应用,可以直接由单质Y和T在低温下合成
难度: 中等查看答案及解析
-
下列叙述错误的是:( )
①热稳定性:H2O>HF>H2S
②沸点:C5H12 > C2H6
③ⅡA族元素的阳离子与上周期稀有气体元素的原子具有相同的核外电子排布
④元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
⑤多电子原子中,在离核较近的区域内运动的电子能量较高
⑥已知H2SO4(aq)+2NaOH(aq)=2H2O(l)+Na2SO4(aq) ΔH= -114.6kJ·mol-1 则中和热为57.3kJ·mol-1
⑦两个非金属元素原子间只可能形成共价键,而含金属元素的化合物中一定含离子键
A.②④⑥ B.①⑤⑥ C.②③④ D.①⑤⑦
难度: 中等查看答案及解析
-
类推的思维方法在化学学习与研究中经常用到,但有时会产生错误的结论。因此,推出的结论最终要经过实践的检验才能决定其是否正确。以下几种类推结论中,正确的是( )
A.第二周期元素氢化物的稳定性顺序是:HF>H2O>NH3;则第三周期元素氢化物的稳定性顺序也是:HCl>H2S>PH3
B.IVA族元素氢化物沸点顺序是:GeH4>SiH4>CH4;则VA族元素氢化物沸点顺序也是:AsH3>PH3>NH3
C.Fe3O4可以写成FeO·Fe2O3;Pb3O4也可以写成PbO·Pb2O3
D.NaHSO4与NaHSO3溶于水显酸性,由所有酸式盐溶于水显酸性
难度: 中等查看答案及解析
-
下列结论正确的是( )
①粒子半径:K+>Al3+>S2->Cl-
②氢化物的稳定性:HF>HCl>H2S>PH3>SiH4
③离子的还原性:S2->Cl->Br->I-
④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>HClO
⑥非金属性:O>N>P>Si
⑦金属性:Be<Mg<Ca<K
A.②⑤⑦ B.②④⑥ C.②④⑤⑥⑦ D.②⑥⑦
难度: 中等查看答案及解析
-
干电池原理示意图如图,电池总反应为:Zn+2NH4+═Zn2++2NH3↑+H2↑,下列说法正确的是( )

A.碳为电池的负极 B.Zn极上发生氧化反应
C.电流由锌极流向碳极 D.H2在Zn片上生成
难度: 简单查看答案及解析
-
分子中所有原子最外层都满足8电子稳定结构的化合物是( )
A.SiO2 B.N2 C.PCl5 D.COCl2
难度: 中等查看答案及解析
-
已知断裂1 mol C—H键,要吸收热量414.4 kJ;断裂1 mol C—C键,要吸收热量347.4 kJ;生成1 mol C=C键,会放出热量615.3 kJ;生成1 mol H—H键,会放出热量435.3 kJ,某有机物分解的反应可表示为:

若在反应中消耗了1 mol乙烷,则有关该反应的说法正确的是( )
A.该反应放出251.2 kJ的热量
B.该反应吸收251.2 kJ的热量
C.该反应放出125.6 kJ的热量
D.该反应吸收125.6 kJ的热量
难度: 中等查看答案及解析
-
钢铁在潮湿的空气中会被腐蚀,发生的原电池反应为:2Fe+2H2O+O2===2Fe(OH)2。以下说法正确的是( )
A.负极发生的反应为:Fe-2e-==Fe2+
B.正极发生的反应为:2H2O+O2+2e-==4OH-
C.原电池是将电能转变为化学能的装置
D.钢柱在水下部分比在水面处更容易腐蚀
难度: 中等查看答案及解析