-
用来区分溶液与胶体的方法是
A.布朗运动 B.电泳现象
C.聚沉 D.丁达尔现象
难度: 简单查看答案及解析
-
下列溶液中Cl-浓度与50 mL 1 mol·L-1 AlCl3溶液中Cl-浓度相等的是
A.150 mL 1 mol·L-1的NaCl溶液
B.75 mL 2 mol·L-1 NH4Cl溶液
C.25 mL 1.5 mol·L-1的MgCl2溶液
D.25 mL 2 mol·L-1的FeCl3溶液
难度: 简单查看答案及解析
-
下列有关化学用语表示正确的是
A.乙酸的结构简式:C2H4O2 B.F-的结构示意图:
C.中子数为 20 的氯原子:
Cl D.NH3的电子式:
难度: 简单查看答案及解析
-
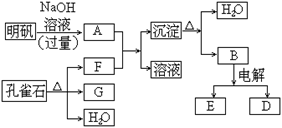
下表所列各组物质中,物质之间通过一步反应就能实现如右图所示转化的是
a
b
c
A
Al
AlCl3
Al(OH)3
B
HNO3
NO
NO2
C
Si
SiO2
H2SiO3
D
Mg
MgO
Mg(OH)2
难度: 简单查看答案及解析
-
下列物质属于强电解质且能导电的是
①氯化钠溶液 ②氯化铵固体 ③铜 ④石墨
⑤熔融NaOH ⑥稀硫酸 ⑦乙酸 ⑧乙醇
A.⑤ B.②⑤ C.①②⑤⑥ D.①③④⑤⑥
难度: 简单查看答案及解析
-
有A、B两个完全相同的装置,某学生分别在它们的侧管中装入1.06 g Na2CO3和0.84 g NaHCO3,A、B中分别有10 mL相同浓度的盐酸,将两个侧管中的物质同时倒入各自的试管中,下列叙述正确的是
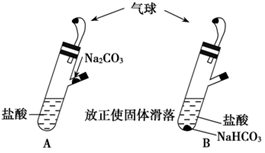
A.A装置的气球膨胀速率大
B.若最终两气球体积相同,则盐酸的浓度一定大于或等于2 mol/L
C.若最终两气球体积不同,则盐酸的浓度一定小于或等于1 mol/L
D.最终两溶液中Na+、Cl-的物质的量相同
难度: 简单查看答案及解析
-
下列推断正确的是
A.SiO2 是酸性氧化物,能与NaOH溶液反应,是制光导纤维的主要原料。
B.Na2O、Na2O2组成元素相同,与 CO2反应产物也相同
C.CO、NO、 NO2都是大气污染气体,在空气中都能稳定存在
D.新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色
难度: 简单查看答案及解析
-
已知:FeSO4·7H2O)
Fe2O3+SO2↑+ SO3↑+ 14H2O,将生成的气体通入BaCl2溶液中,下列叙述中正确的是
A.有BaSO4生成 B.有BaSO3生成
C.同时有BaSO4和BaSO3生成 D.有SO3逸出
难度: 简单查看答案及解析
-
在下列各溶液中,离子一定能大量共存的是
A.强碱性溶液中: K+、Al3+、Cl-、SO42-
B.在由水电离产生的H+浓度为1×10-13mol·L-1的溶液中,Na+、K+、Cl-、HCO3-、SiO32-
C.含有0.1 mol·L-1Ca2+溶液在中: Na+、K+、CO32-、Cl-
D.室温下,pH=1的溶液中: Na+、Fe3+、NO3-、SO42-
难度: 简单查看答案及解析
-
某同学在实验报告中记录下列数据,其中正确的是
A.用25 mL量筒量取12.36 mL盐酸 B.托盘天平称取8.75克食盐
C.用酸式滴定管量取23.22mL高锰酸钾溶液 D.用广泛pH试纸测得某溶液pH为3.5
难度: 简单查看答案及解析
-
下列除杂质的方法不可行的是
A.用过量氨水除去Al3+溶液中的少量Fe3+
B.将混合气体通过灼热的铜网除去N2中的少量O2
C.用新制的生石灰,通过加热蒸馏,以除去乙醇中的少量水
D.用盐酸除去AgCl中少量的Ag2CO3
难度: 简单查看答案及解析
-
氧化还原反应中,水的作用可以是氧化剂、还原剂、既是氧化剂又是还原剂、既非氧化剂又非还原剂等。下列反应与Br2+SO2+2H2O=H2SO4+2HBr相比较,水的作用不相同的是
A.2Na2O2+2H2O=4NaOH+O2↑
B.2Al+2NaOH+2H2O=2NaAlO2+3H2↑
C.3NO2+2H2O=3HNO3+NO
D.4Fe(OH)2+O2+2H2O=4Fe(OH)3
难度: 简单查看答案及解析
-
据报道,科学家已成功合成了少量N4,有关N4的说法正确的是
A.N4是N2的同素异形体
B.N4是N2的同位素
C.相同质量的N4和N2所含原子个数比为1:2
D.N4的摩尔质量是56g
难度: 简单查看答案及解析
-
将适量的SO2通过入Fe(NO3)3溶液中,溶液由棕黄色变为浅绿色,但立即又变为棕黄色,继续滴入BaCl2溶液,产生白色沉淀。在上述一系列变化过程中,最终被还原的元素是
A.S B.Fe C.Cl D.N
难度: 简单查看答案及解析
-
下列离子方程式书写正确的是
A.Fe(NO3)3溶液中加入过量的HI溶液:3Fe3++2I-=3Fe2++I2
B.NaNO2溶液中加入酸性KMnO4溶液:2MnO4-+5NO2-+6H+=2Mn2++5NO3-+3H2O
C.漂白粉溶液中通入过量CO2气体:Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO
D.向NH4Al(SO4)2溶液中不断滴加Ba(OH)2至溶液中SO42-完全沉淀;
2Ba2-+4OH-+Al3++2SO42=2BaSO4↓+AlO2-+2H2O
难度: 简单查看答案及解析
-
常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:
2Fe2++H2O2+2H+=2Fe3++2H2O, 2Fe3++H2O2=2Fe2++O2↑+2H+,
下列说法正确的是
A.H2O2的氧化氢比Fe3+强,其还原性比Fe2+弱
B.在H2O2分解过程中,溶液的pH逐渐下降
C.在H2O2分解过程中, Fe2+和Fe3+的总量减少
D.H2O2生产过程要严格避免混入Fe2+
难度: 简单查看答案及解析
-
从下列事实所得出的相应结论正确的是
实验事实
结论
A
氢氧化铝可以溶解在氢氧化钠溶液中
氢氧化铝属于碱
B
CO2的水溶液可导电
CO2是电解质
C
SO2通入酸性高锰酸钾溶液,溶液褪色
SO2有漂白性
D
铁分别和氯气、硫反应得到氯化铁和硫化亚铁
氯气的氧化性大于硫
难度: 简单查看答案及解析
-
某无色溶液,由Na+、Ba2+、Al3+、AlO2-、Fe3+、CO32-、SO42-中的若干种组成。取适量该溶液进行如下实验:①加入过量盐酸有气体生成;②在①所得溶液中再加入过量NH4HCO3溶液,有气体生成并析出白色沉淀甲;③在②所得溶液中加入过量Ba(OH)2溶液也有气体生成并产生白色沉淀乙,则原溶液中一定存在的离子是
A.Al3+、Fe3+、SO42- B.Na+、AlO2-、CO32-
C.Na+、Al3+、CO32-、SO42- D.Na+、Ba2+、AlO2-
难度: 简单查看答案及解析
-
某学生设计了如下图中的方法对A盐进行鉴定:
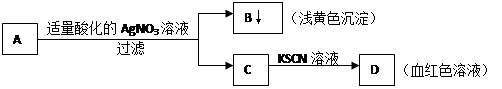
由此分析,下列结论中,正确的是
A.A中一定有Fe3+ B.C中一定有Fe3+
C.B为AgI沉淀 D.A一定为FeBr2溶液
难度: 简单查看答案及解析
-
甲、乙两烧杯中分别装有相同体积、相同pH的氨水和NaOH溶液,各加入10mL 0.1 mol·L-1 AlCl3溶液,两烧杯中都有沉淀生成。下列判断正确的是
A.甲中沉淀一定比乙中的多
B.甲中沉淀可能比乙中的多
C.甲中沉淀一定比乙中的少
D.实验过程中甲中和乙中的现象始终保持一致
难度: 简单查看答案及解析