-
下列各组物质中,X是主体物质,Y是少量杂质,Z是为除去杂质所要加入的试剂,其中所加试剂正确的一组是( )
A B C D X FeCl2溶液 FeCl3溶液 Cl2 Na2SO4溶液 Y FeCl3 CuCl2 HCl Na2CO3 Z Cl2 Fe 饱和食盐水 BaCl2溶液
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
分类方法在化学学科的发展中起到了非常重要的作用.下列分类标准合理的是( )
①根据酸分子中含有的氢原子个数将酸分为一元酸、二元酸等
②根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应
③根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液
④根据反应中是否有离子参加将化学反应分为离子反应和非离子反应.
A.①②
B.③④
C.①③
D.②④难度: 中等查看答案及解析
-
东北老工业区曾经有这样一句顺口溜“天明的晚黑的快,洗脸快不如脏的快”,这是因为该地区从早到晚一直处于红棕色烟雾中,附近居民深受其害.你估计这一空气污染物中可能含有( )
A.煤炭粉尘
B.P2O5粉末
C.SiO2粉尘
D.Fe2O3粉尘难度: 中等查看答案及解析
-
下列关于纯净物、混合物、强电解质、弱电解质和非电解质的正确组合是( )
纯净物 混合物 强电解质 弱电解质 非电解质 A 盐酸 水煤气 硫酸 醋酸 干冰 B 氢氧化钡 蔗糖溶液 硫酸钡 醋酸 三氧化硫 C 胆矾 石灰水 苛性钾 水 碳酸钙 D 重钙 普钙 氯化钠 氢氧化铁 氢气
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
下列有关化学反应过程或实验现象的解释中,正确的是( )
A.Fe(OH)3胶体中加入Na2SO4溶液后有红褐色沉淀生成,说明胶体是不稳定的分散系
B.H2S能与CuSO4溶液反应生成H2SO4,说明氢硫酸的酸性比硫酸强
C.向淀粉碘化钾溶液中加入氯水,溶液变为蓝色,说明Cl2的氧化性强于I2
D.向滴有酚酞的Na2CO3溶液中加入BaCl2溶液,溶液退色,说明BaCl2有酸性难度: 中等查看答案及解析
-
如图表示的一些物质或概念间的从属关系中正确的是( )
X Y Z A 纯净物 化合物 氧化物 B 电解质 离子化合物 化合物 C 胶体 分散系 混合物 D 酸性氧化物 碱性氧化物 金属氧化物 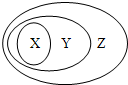
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
某化学兴趣小组欲研究H2SO4、NaCl、KCl、Na2CO3、FeCl3、NaOH的性质,对于如何研究,他们设计了两种研究方案:
方案1:将它们按照酸、碱、盐分类,然后分别溶于水得到溶液,进行实验.
方案2:将它们按照钠盐、钾盐、铁盐和其他化合物分类,然后分别溶于水得到溶液,进行实验.
下列说法正确的是( )
A.按照方案1属于碱的有Na2CO3、NaOH
B.按照方案2属于钠盐的有NaCl、Na2CO3、NaOH
C.方案1中的碱与方案2中的铁盐反应可得到一种红褐色胶体
D.设计方案2的同学取某种溶液,在其中加入上述溶液中的钾盐溶液有白色沉淀产生,加入稀硝酸沉淀不消失,则该溶液中一定含有Ag+难度: 中等查看答案及解析
-
NA代表阿伏加德罗常数,下列叙述正确的是( )
A.10mL质量分数为98%的H2SO4,用水稀释至100mL,H2SO4的质量分数为9.8%
B.在H2O2+Cl2═2HCl+O2反应中,每生成32g氧气,则转移4NA个电子
C.标准状况下,分子数为NA的CO、C2H4混合气体体积约为22.4L,质量为28g
D.标准状况下,2.24LH2O含有的分子数等于0.1NA难度: 中等查看答案及解析
-
已知:Cu+2Fe3+═2Fe2++Cu2+.现把相同物质的量的CuSO4、FeCl3和Zn置于水中充分反应,反应所得混合物中除含有SO42-和Cl-外,还含有( )
A.Zn2+、Cu、Fe3+
B.Zn、Cu2+、Fe3+
C.Zn2+、Cu2+、Fe2+
D.Zn2+、Cu、Cu2+、Fe2+难度: 中等查看答案及解析
-
在含有碳酸根离子,且能使酚酞变红的无色溶液中,能大量共存的离子组是( )
A.Na+、SO32-、SO42-、K+
B.Na+、Cu2+、Br-、Ba2+
C.K+、MnO4-、NO3-、Na+
D.K+、Ca2+、SO32-、Cl-难度: 中等查看答案及解析
-
下列反应的离子方程式书写正确的是( )
A.过量CO2和Ca(OH)2溶液反应:2OH-+Ca2++CO2═CaCO3↓+2H2O
B.碳酸钙与醋酸溶液反应:CaCO3+2H+═Ca2++CO2↑+H2O
C.硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液:Fe2++2H++H2O2═Fe3++2H2O
D.向硫酸铜溶液中滴加氢氧化钡溶液至SO42-恰好沉淀完全:Cu2++SO42-+2OH-+Ba2+═Cu(OH)2↓+BaSO4↓难度: 中等查看答案及解析
-
氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于阴影部分的是( )
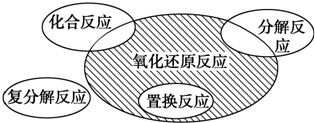
A.Cl2+2KBr═Br2+2KCl
B.2NaHCO3Na2CO3+H2O+CO2↑
C.4Fe(OH)2+O2+2H2O═4Fe(OH)3
D.2Na2O2+2CO2═2Na2CO3+O2难度: 中等查看答案及解析
-
相同条件下能进行以下三个反应:①2A-+B2═A2+2B-;②2C-+A2═2A-+C2;③2B-+D2═2D-+B2.由此可得出的分析结论正确的是( )
A.氧化性:A2>B2>C2>D2
B.还原性:C-<A-<B-<D-
C.2A-+D2═2D-+A2的反应可以发生
D.2B-+C2═2C-+B2的反应可以发生难度: 中等查看答案及解析
-
有三种说法:
①NH4NO3中氮元素显+5价;
②4FeS2+11O2-→2Fe2O3+8SO2反应中+2价铁和-2价硫都被氧化;
③氧化还原反应中还原剂得电子数与氧化剂失电子数一定相等.
这三种说法中错误的是( )
A.只有①
B.只有②③
C.只有①③
D.①②③难度: 中等查看答案及解析
-
已知单质铁溶于一定浓度的HNO3溶液中反应的离子方程式为:aFe+bNO3-+cH+═dFe2++fFe3++gNO↑+hN2O↑+kH2O,化学计量数a~k均为正整数.则它们之间的关系错误的是( )
A.c=4g+10h
B.a+c=d+f
C.2d+3f=3g+8h
D.c-b=2d+3f难度: 中等查看答案及解析
-
将1.12g铁粉加入25mL 2mol•L-1的氯化铁溶液中,充分反应后,其结果是( )
A.铁有剩余,溶液呈浅绿色,Cl-浓度基本不变
B.往溶液中滴入无色KSCN溶液,显黄色
C.Fe2+和Fe3+的物质的量之比为6:1
D.氧化产物与还原产物的物质的量之比为2:5难度: 中等查看答案及解析