-
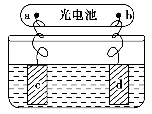
甲醇燃料电池被认为是21世纪电动汽车的最佳候选动力源,其工作原理如图所示。下列有关叙述正确的是( )。
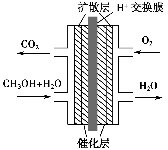
A.通氧气的一极为负极
B.H+从正极区通过交换膜移向负极区
C.通甲醇的一极的电极反应式为CH3OH+H2O-6e-=CO2↑+6H+
D.甲醇在正极发生反应,电子经过外电路流向负极
难度: 中等查看答案及解析
-
工业上可用软锰矿(主要成分为MnO2)和闪锌矿(主要成分为ZnS)制取干电池中所需的MnO2和Zn,其工艺流程如下:
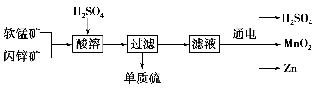
下列说法正确的是 ( )。
A.酸溶时,MnO2作还原剂
B.可用盐酸代替硫酸进行酸溶
C.原料硫酸可以循环使用
D.在电解池的阴极处产生MnO2
难度: 中等查看答案及解析
-
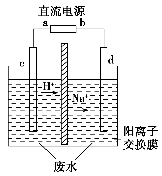
如图所示,Ⓐ为直流电源,Ⓑ为浸透饱和氯化钠溶液和酚酞试液的滤纸,Ⓒ为电镀槽。接通电路(未闭合K)后发现Ⓑ上的c点显红色。为实现铁片上镀铜,接通K后,使c、d两点短路。下列叙述不正确的是 ( )。

A.b为直流电源的负极
B.f极为阴极,发生还原反应
C.e极材料为铁片,f极材料为铜片
D.可选用CuSO4溶液或CuCl2溶液作电镀液
难度: 中等查看答案及解析
-
电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开。在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。
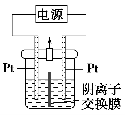
已知:3I2+6OH-=IO3—+5I-+3H2O
下列说法不正确的是 ( )。
A.右侧发生的电极反应式:2H2O+2e-=H2↑+2OH-
B.电解结束时,右侧溶液中含IO3—
C.电解槽内发生反应的总化学方程式:KI+3H2O
KIO3+3H2↑
D.如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学反应不变
难度: 中等查看答案及解析
-
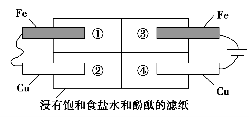
下列与金属腐蚀有关的说法,正确的是( )。
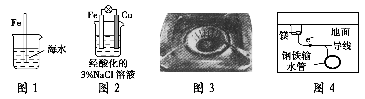
A.图1中,插入海水中的铁棒,越靠近底端腐蚀越严重
B.图2中,往烧杯中滴加几滴KSCN溶液,溶液变血红色
C.图3中,燃气灶的中心部位容易生锈,主要是由于高温下铁发生化学腐蚀
D.图4中,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块相当于原电池的正极
难度: 中等查看答案及解析
-
如图中,两电极上发生的电极反应如下:
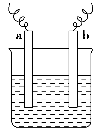
a极:Cu2++2e-=Cu;b极:Fe-2e-=Fe2+,则以下说法中不正确的是( )。
A.该装置一定是原电池
B.a极上一定发生还原反应
C.a、b可以是同种电极材料
D.该过程中能量的转换可以是电能转化为化学能
难度: 中等查看答案及解析
-
为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。反应原理如下:
电池:Pb(s)+PbO2(s)+2H2SO4(aq)=2PbSO4(s)+2H2O(l)
电解池:2Al+3H2O电解,Al2O3+3H2↑
电解过程中,以下判断正确的是 ( )。
电池 电解池
A H+移向Pb电极 H+移向Pb电极
B 每消耗3 mol Pb 生成2 mol Al2O3
C 正极:PbO2+4H++2e-=Pb2++2H2O 阳极:3Al+3H2O-6e-=Al2O3+6H+
D
难度: 困难查看答案及解析
-
下图是某同学设计的原电池装置,下列叙述中正确的是( )。

A.电极Ⅰ上发生还原反应,做原电池的正极
B.电极Ⅱ的电极反应式为Cu2++2e-=Cu
C.该原电池的总反应式为2Fe3++Cu=Cu2++2Fe2+
D.盐桥中装有含氯化钾的琼脂,其作用是传递电子
难度: 中等查看答案及解析
 胶体
胶体 Li2FeSiO4。
Li2FeSiO4。