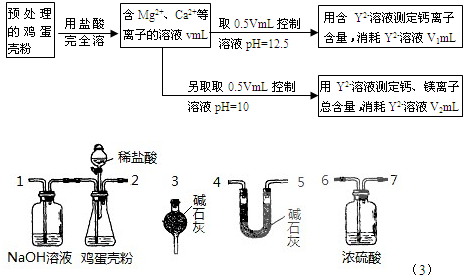
-
《中华人民共和国食品安全法》于2009年月1日起实施.下列做法不利于安全的是( )
A.用聚氯乙烯塑料袋包装食品
B.在食品盐中添加适量的碘酸钾
C.在食品加工中科学使用食品添加剂
D.研发高效低毒的农药,降低蔬菜的农药残留量难度: 中等查看答案及解析
-
氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域.在一定条件下,氮化铝可通过如下反应合成:Al2O3+N2+3C
2AlN+3CO.下列叙述正确的是( )
A.在氮化铝的合成反应中,N2是还原剂,Al2O3是氧化剂
B.上述反应中每生成2 mol AlN,N2得到3 mol电子
C.氮化铝中氮元素的化合价为-3
D.氮化铝晶体属于分子晶体难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
A.常温常压下的33.6L氯气与足量铝充分反应,转移电子数为3NA
B.标准状况下,22.4L己烷中共价键数目为19NA
C.由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA
D.在1molNa2O2晶体中阳离子与阴离子总数为4NA难度: 中等查看答案及解析
-
下列有关化学用语使用正确的是( )
A.硫原子的原子结构示意图:
B.NH4Cl的电子式:
C.原子核内有10个中子的氧原子:818O
D.对氯甲苯的结构简式:难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是( )
A.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O═Fe(OH)3↓+3H+
B.用小苏打治疗胃酸过多:HCO3-+H+═CO2↑+H2O
C.实验室用浓盐酸与MnO2反应制Cl2:MnO2+2H++2Cl-═Cl2↑+Mn2++H2O
D.用FeCl3溶液腐蚀印刷电路板:Fe3++Cu═Fe2++Cu2+难度: 中等查看答案及解析
-
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)═CO2(g)+3H2(g);△H=+49.0kJ•mol-1
②CH3OH(g)+O2(g)═CO2(g)+2H2(g);△H=-192.9kJ•mol-1
下列说法正确的是( )
A.CH3OH的燃烧热为192.9kJ•mol-1
B.反应①中的能量变化如图所示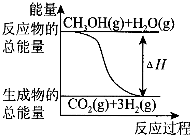
C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应:CH3OH(l)+O2(g)=CO2(g)+2H2(g)的△H>-192.9kJ•mol-1
难度: 中等查看答案及解析
-
下列有关试验操作的叙述正确的是( )

A.实验室常用右图所示的装置制取少量的乙酸乙酯
B.用50mL酸式滴定管可准确量取25.00mLKMnO4溶液
C.用量筒取5.00mL1.00mol•L-1盐酸于50mL容量瓶中,加水稀释至刻度,可配制0.100mol•L-1盐酸
D.在苯萃取溴水中的溴,分液时有机层从分液漏斗的下端放出难度: 中等查看答案及解析