-
化学在生活和工业生产中有着广泛的应用,下列对应关系错误的是
A.Al2(SO4)3和小苏打反应,可用于泡沫灭火器灭火
B.次氯酸盐具有氧化性,可用于漂白织物
C.铁比铜金属性强,可用Fe腐蚀Cu刻制印刷电路板
D.HF与SiO2反应,氢氟酸可用于在玻璃器皿上刻蚀标记
难度: 中等查看答案及解析
-
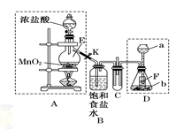
下列有关实验的操作和结论正确的是
A. 明矾和漂白粉均可用于自来水的杀菌、消毒
B. 用丁达尔实验可以将Al(OH)3胶体和NaCl溶液区分
C. CCl4萃取碘水中的I2 ,先从分液漏斗下口放出有机层,后从分液漏斗下口放出水层
D. 浓盐酸与MnO2反应制备纯净Cl2,气体产物先通过浓硫酸,后通过饱和食盐水
难度: 简单查看答案及解析
-
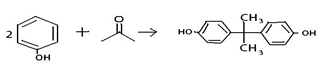
下列有关化学用语正确的是
A.NH4Cl的电子式:
Cl-
B.2-氯甲苯的结构简式:
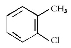
C.S2-的结构示意图:
D.质子数为94、中子数为144的钚(Pu)原子:
难度: 简单查看答案及解析
-
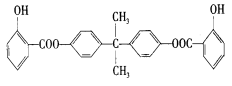
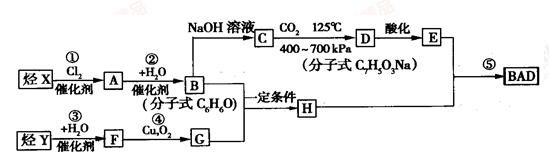
乙酸橙花酯是一种无色至微黄色油状液体,有橙花和玫瑰样香气,其结构简式如图所示,关于该有机物的下列叙述中正确的是
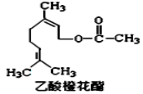
A.它的同分异构体中可能有芳香族化合物,
B.能发生加成反应,但不能发生取代反应
C.lmol该有机物在一定条件下和H2反应,共消耗H2为3mol
D.lmol该有机物水解时只能消耗lmo1NaOH
难度: 简单查看答案及解析
-
下列关于离子共存的说法正确的是
A.某无色溶液中可能大量存在H+、Cl-、MnO4-
B.pH=2的溶液中可能大量存在Na+、NH4+、SiO32-
C.含AlO2-的溶液中:Na+、K+、NO3-、Al3+
D.含大量Fe3+的溶液中:K+、Na+、NO3-、H+
难度: 简单查看答案及解析
-
设NA代表阿伏加德罗常数的数值,下列说法中正确的是
A.0.1L0.5mol/LCH3COOH溶液中含有的氢离子数为0.05NA
B.常温下,16gO2和O3的混合气体中含有的氧原子数为NA
C.标准状况下,22.4 L NO 和22.4 L O2 混合后所得气体中分子总数为1.5 NA
D.1molFeCl3与沸水反应生成胶体后,含有NA个Fe(OH)3胶粒
难度: 中等查看答案及解析
-
下列解释事实的离子方程式正确的是
A.Fe2+与H2O2在酸性溶液中的反应:2Fe2++H2O2+2H+=2Fe3++2H2O
B.澄清石灰水与少量小苏打溶液混合:Ca2+ +2OH- +2HCO3- = CaCO3↓+ CO32- + 2H2O
C.少量CO2通入苯酚钠溶液中:2C6H5O-+CO2+H2O=2C6H5OH+ CO32-
D.向NH4HSO4稀溶液中逐滴加入Ba(OH)2稀溶液至SO42-刚好沉淀完全: Ba2+ + 2OH- +2H+ + SO4 2- = BaSO4↓+ 2H2O
难度: 简单查看答案及解析
-
常温下,下列有关叙述正确的是
A.0.1 mol/L的CH3COOH溶液和0.1 mol/L的CH3COONa溶液等体积混合c(CH3COO-)+c(OH-)=c(Na+)+c(H+)
B.同浓度的①NH4C1、②(NH4)2SO4、③NH4HSO4三种溶液中,c(NH4+)大小顺序为:①=②>③
C.Na2CO3溶液中,2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
D.10mLpH=12的氢氧化钠溶液中加入pH=2的HA至pH刚好等于7,所得溶液体积V(总)≥20mL
难度: 困难查看答案及解析
-
下列有关电解质溶液的说法正确的是
A. 向盐酸中加入氨水至中性,溶液中
>1
B.向0.1mol/L CH3COOH溶液中加入少量水,溶液中
 增大
增大C.在蒸馏水中滴加浓H2SO4,Kw不变
D.将CH3COONa溶液从20℃升温至30℃,溶液中
 增大
增大难度: 中等查看答案及解析
-
下列关于有机化合物的说法正确的是
A.由乙烯生成乙醇属于加成反应
B.2-甲基丁烷也称异丁烷
C.油脂和蛋白质都属于高分子化合物
D.C4H9Cl有3种同分异构体
难度: 简单查看答案及解析
-
下列图中的实验方案,能达到实验目的的是
A
B
C
D
实验方案
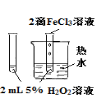
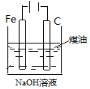

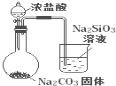
实验
目的
验证FeCl3对H2O2分解反应有催化作用
制备Fe(OH)2并能较长时间观察其颜色
除去CO2气体中混有的SO2
比较HCl、H2CO3和H2SiO3的酸性强弱
难度: 中等查看答案及解析
-
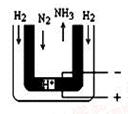
三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述不正确的是

A.当电路中通过4mol电子的电量时,生成有标准状况下的O2为22.4L
B.该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C.正极区反应为2H2O–4e–=O2+4H+,正极区溶液pH降低
D.通电后中间隔室的SO42-离子向负极区迁移,负极区溶液pH增大
难度: 困难查看答案及解析
-
实验用含有杂质(FeO、Fe2O3)的废CuO制备胆矾晶体经历下列过程,Fe3+在pH=5时早已完全沉淀。其分析错误的是

A.若要测定所得硫酸铜晶体中结晶水的数目,实验中要用到坩埚、坩埚钳和干燥器等
B.利用Cu(OH)2替代CuO也可调试溶液pH,不影响实验结果
C.洗涤晶体:向滤出晶体的漏斗中加少量冷水浸没晶体,自然流下,重复2-3次
D.用18.4mol/L浓硫酸配制溶解所用4.00mol/L的稀硫酸,玻璃仪器一般只有4种
难度: 简单查看答案及解析
-
已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16。下列说法错误的是
A.AgCl不溶于水,不能转化为AgI
B.在含有浓度均为0.001 mol·L-1的Cl-、I-的溶液中缓慢加入AgNO3稀溶液,首先析出AgI沉淀
C.AgI比AgCl更难溶于水,所以,AgCl可以转化为AgI
D.常温下AgCl在NaI溶液中开始转化为AgI则NaI的浓度必须不低于
×10-11 mol·L-1
难度: 中等查看答案及解析
-
四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性。下列说法正确的是
A. W与X形成的化合物溶于水后溶液呈碱性
B. 简单离子半径:W<X<Z
C. 气态氢化物的热稳定性:W<Y
D. 最高价氧化物的水化物的酸性:Y>Z
难度: 简单查看答案及解析
-
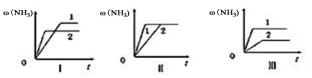
根据下列有关图象,说法正确的是
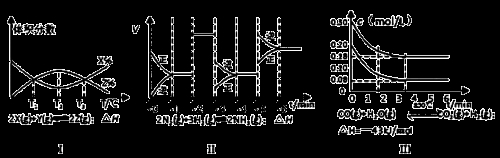
A.由图Ⅰ知,反应在T1、T3处达到平衡,且该反应的△H<0
B.由图Ⅱ知,反应在t6时,NH3体积分数最大
C.由图Ⅱ知,t3时采取的措施是降低反应体系温度
D.Ⅲ在10L容器、850℃时反应,由图知,到4min时,反应放出51.6kJ的热量
难度: 简单查看答案及解析